Фумонизин B 1 является наиболее распространенным членом семейства токсинов, известных как фумонизины , продуцируемых несколькими видами плесени Fusarium , такими как Fusarium verticillioides , [1] которые встречаются в основном в кукурузе (кукурузе), пшенице и других зерновых культурах. Во всем мире сообщалось о загрязнении кукурузы фумонизином B1 на уровне мг/кг. Воздействие на человека происходит на уровне от микрограммов до миллиграммов в день и является наибольшим в регионах, где продукты кукурузы являются основным продуктом питания.
Фумонизин B 1 является гепатотоксичным и нефротоксичным для всех исследованных видов животных. Самым ранним гистологическим изменением, которое появляется в печени или почках животных, получавших фумонизин, является усиление апоптоза с последующей регенеративной пролиферацией клеток. Хотя острая токсичность фумонизина невелика, он является известной причиной двух заболеваний, возникающих у домашних животных с быстрым началом: лейкоэнцефаломаляции лошадей и синдрома отека легких у свиней. Оба эти заболевания сопровождаются нарушением метаболизма сфинголипидов и сердечно-сосудистой дисфункцией.
В 1970 году вспышка лейкоэнцефаломаляции у лошадей в Южной Африке была связана с заражением кукурузы грибом Fusarium verticillioides . [2] Это один из наиболее распространенных семенных грибов, связанных с кукурузой. [3] Еще одно исследование было проведено о возможной роли грибковых токсинов в этиологии рака пищевода человека в регионе Южной Африки. Диета людей, живущих в этом районе, состояла из кукурузы, выращенной в домашних условиях, а F. verticillioides был наиболее распространенным грибком в кукурузе, которую потребляли люди с высокой заболеваемостью раком пищевода. [3] Дальнейшие вспышки лейкоэнцефаломаляции и люди в некоторых регионах с высокой заболеваемостью раком пищевода привели к увеличению количества исследований F. verticillioides . Вскоре экспериментально установили, что F. verticillioides вызывает лейкоэнцефаломаляцию у лошадей и отек легких у свиней. Было обнаружено, что он обладает высокой гепатотоксичностью и кардиотоксичностью у крыс. В 1984 г. было показано, что гриб оказывает гепатоканцерогенное действие на крыс. [3] Химическая природа метаболитов, вызывающих все это, еще не была открыта в 1984 году. После открытия канцерогенности гриба, выделение и химическая характеристика микотоксинов и канцерогенов, продуцируемых F. verticillioides, стали актуальными. Лишь в 1988 году химическая природа канцерогена была раскрыта. Фумонизин B 1 и фумонизин B 2 были выделены из культур F. verticillioides в рамках Программы по микотоксинам и экспериментальному канцерогенезу. [4] Структуры были выяснены в сотрудничестве с Советом по научным и промышленным исследованиям. [5] Несколько изомеров фумонизина B1 были обнаружены в твердой культуре риса. [6] В настоящее время известно более 100 различных фумонизинов, наиболее важными из которых являются фумонизины B 1 , B 2 и B 3 . [7] [8]
Что касается токсикокинетики, данных о людях нет, но исследования на животных проводились.
FB 1 принимается перорально с пищей. В целом FB 1 усваивается плохо, менее 6%. [9] Абсорбция перорально введенного фумонизина B 1 (10 мг/кг массы тела) у крыс низкая (3,5% дозы), но быстрая (T max = 1,02 часа). [10] FB 1 незначительно проникает через кожу человека и, следовательно, не имеет значительного системного риска для здоровья после воздействия на кожу. [11]
После абсорбции некоторое количество сохраняется в печени и почках. У крыс, которых в течение нескольких недель кормили рационами, содержащими фумонизины, концентрации фумонизинов в почках были примерно в 10 раз выше, чем в печени. [12]
Распределение поглощенной дозы в плазме соответствовало открытой двухкамерной модели , а результаты временной концентрации в тканях (печени, почках) соответствовали открытой однокамерной модели . [10]
Период полувыведения у крыс составляет 3,15 часа для плазмы, 4,07 часа для печени и 7,07 часа для почек. [10] Однако FB 1 быстро выводится преимущественно в исходной форме. Небольшие количества выводятся с мочой; большая часть выводится с калом. [9]
Благодаря своему сходству фумонизины способны ингибировать сфингозин -сфинганин-трансферазы и церамидсинтазы и, следовательно , являются конкурентными ингибиторами биосинтеза и метаболизма сфинголипидов .

На рисунке 2 показан метаболизм сфинголипидов (схематически) и ингибирование, вызываемое фумонизинами. Фумонизин В 1 ингибирует фермент церамидсинтазу (сфингозин -N -ацилтрансферазу), который ацилирует сфингоидные основания. Это блокирует образование церамидов двумя путями. Он ингибирует деформацию за счет сфинганина de novo и жирного ацил-КоА , а также за счет сфингозина, образующегося в результате расщепления церамида церамидазой. Ингибирование приводит к увеличению концентрации сфинганина, сфингозина и их 1-фосфатных метаболитов и снижению концентрации сложных сфинголипидов. Накопление сфинганина и сфингозина является основной причиной токсичности фумонизина B 1 [14]. Сфинганин и сфингозин цитотоксичны и обладают эффектом ингибирования роста. Кроме того, эти сфингоидные основания вызывают апоптоз. Повышенный апоптоз, по-видимому, играет важную роль в токсических эффектах, включая индукцию опухоли. [9] Однако следует отметить, что пониженная концентрация церамида и повышенная концентрация сфингозин-1-фосфата (в результате приема FB 1 ) вызывают ингибирование апоптоза и способствуют митозу и регенерации. [14] Баланс между внутриклеточной концентрацией соединений, ингибирующих апоптоз, и тех, которые индуцируют апоптоз, будет определять клеточный ответ. [15] Кроме того, снижение концентрации сложных сфинголипидов, по-видимому, играет роль в аномальном поведении и изменении морфологии пораженных клеток. [12]
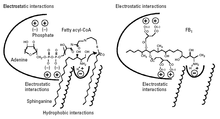
Предлагаемый механизм действия изображен на фигуре 3. Фумонизин B 1 занимает место и электростатические взаимодействия как сфинганина (или сфингозина), так и жирного ацил-КоА в церамидсинтазе. Часть FB 1 , имеющая структурное сходство со сфингоидными основаниями (аминопентоловая часть), может взаимодействовать с сайтом связывания сфинганина, тогда как отрицательно заряженные группы трикарбиловой кислоты могут взаимодействовать с сайтом связывания жирного ацил-КоА. [9]
Поскольку FB 1 также занимает пространство жирного ацил-КоА, он не ацилируется, поскольку ацил-КоА необходим для ацилирования; FB 1 ингибирует только церамидсинтазу. Однако когда группы трикарбиловой кислоты удаляются из FB 1 путем гидролиза, образующийся продукт (аминопентол, AP1) действует не только как ингибитор, но и как субстрат для церамидсинтазы; аминопентол ацилируется церамидсинтазой с образованием N-пальмитоил-AP1. [14] Это подтверждает предположение о том, что аминопентоловая часть FB 1 занимает место сфинганина в ферменте. N-пальмитоил-АР1 является еще более мощным ингибитором церамидсинтазы и, следовательно, может играть роль в токсичности никстамализованных фумонизинов. [14]
Риски фумонизина B1 были оценены Международной программой по химической безопасности Всемирной организации здравоохранения и Научным комитетом по пищевым продуктам Европейской комиссии. Они определили переносимую суточную дозу FB 1 , FB 2 , FB 3 отдельно или в комбинации в размере 2 мкг/кг массы тела. [16] До сих пор ничего о кинетике и метаболизме фумонизина B 1 у человека не сообщалось. На других животных было проведено много исследований, но их нельзя сравнивать с людьми. У мышей выведение FB 1 происходит очень быстро, но у людей оно может быть намного медленнее, учитывая их массу тела. [7] Существует несколько возможных путей возникновения токсических эффектов фумонизина B 1 . Большинство токсических эффектов обусловлено изменением метаболизма сфинголипидов за счет ингибирования церамидсинтазы. Может произойти производство активных форм кислорода. Это увеличивает окислительный стресс, вызывает перекисное окисление липидов и может повредить клетки. В соответствии с этим некоторые исследования показали снижение уровня глутатиона в печени, но другие исследования показали даже повышенный уровень глутатиона. [7] Сообщалось также о цитотоксических эффектах. [7] Другим эффектом воздействия FB 1 является апоптоз. Это наблюдалось в ряде различных клеток и тканей. Ингибирование церамидсинтазы не является причиной этого эффекта. Основными факторами могут быть фрагментация ДНК и активация каспазы-3. [7] FB 1 также обладает иммунотоксическим действием, но необходимо гораздо больше исследований, чтобы получить четкое представление о влиянии на иммунную систему.
Дефект нервной трубки — это аномалии головного и спинного мозга у эмбриона, возникающие в результате нарушения закрытия нервной трубки. [17] Эпидемиологические исследования и клинические испытания показали, что дефицит фолиевой кислоты является основным фактором риска дефектов нервной трубки. [18] FB 1 нарушает метаболизм сфинголипидов и, следовательно, это может повлиять на поглощение фолиевой кислоты и вызвать дефекты нервной трубки. [7] В 1990 и 1991 годах на границе Техаса и Мексики произошла внезапная вспышка дефектов нервной трубки. Считается, что эта вспышка могла быть вызвана высокими уровнями FB 1 , наблюдавшимися в кукурузе в предыдущие годы. [19] В регионах Китая и Южной Африки с высоким потреблением кукурузы также высока распространенность дефектов нервной трубки. [7] [20]
Считается, что существует связь между возникновением F. verticillioides и раком пищевода человека. Низкий социально-экономический статус и менее разнообразная диета, состоящая в основном из кукурузы и пшеницы, связаны с возникновением рака пищевода. [7] Это следует из эпидемиологических исследований, проведенных в различных странах. Другие исследования показывают, что более высокие концентрации FB 1 , FB 2 и F. verticillioides присутствуют в кукурузе, произрастающей в регионах с высоким процентом рака пищевода. Это контрастирует с регионами с низким уровнем F. verticillioides , FB 1 и FB 2 в кукурузе. [21] Кроме того, похоже, что люди с высоким потреблением кукурузы подвергаются более высокому риску развития рака пищевода, чем люди с низким потреблением кукурузы. Это наблюдают люди в регионах Италии, Ирана, Кении, Зимбабве, США и Бразилии с высокой заболеваемостью раком пищевода. [22] Другое исследование взаимосвязи между уровнями сфинголипидов и заболеваемостью раком не выявило какой-либо значимой связи между сфинголипидами сыворотки и риском рака пищевода. Это весьма примечательно, поскольку считается, что повышенные уровни сфинголипидов сфинганина и сфингозина являются биомаркерами воздействия FB 1 . [7]
Острый микотоксикоз – пищевое отравление продуктами питания, зараженными грибами. В 1995 году вспышка заболевания, характеризующегося диареей и болями в животе, произошла в 27 деревнях Индии. Это произошло в результате потребления заплесневелого сорго и кукурузы из-за повреждения дождем. Эта вспышка была изучена и микотоксикоз был связан с употреблением в пищу пресного хлеба. Образцы кукурузы и сорго были собраны в домохозяйствах и исследованы. Кукуруза и сорго были заражены Fusarium и Aspergillus и содержали высокие уровни FB 1 по сравнению с образцами незатронутых домохозяйств. [7]
Было проведено много исследований токсического воздействия FB 1 на животных. Исследования in vivo показывают, что печень и почки являются основными органами-мишенями. [7] Фумонизины плохо всасываются, быстро выводятся и не метаболизируются у животных. [23] У свиней и крыс FB 1 широко распространен, и было обнаружено, что небольшие количества накапливаются только в печени и почках. У верветок некоторое количество FB 1 частично гидролизуется в кишечнике. [7]
У крыс и мышей, подвергшихся воздействию FB 1 , происходило опухолеобразование. Было проведено несколько исследований на эту тему. В зависимости от используемой линии мышей были показаны различные карциномы. [7] Показано, что FB 1 негенотоксичен. Следовательно, механизмы, ответственные за развитие рака, должны лежать в другом месте. Важными механизмами развития рака, вызванного фумонизином B 1, могут быть окислительное повреждение (производство активных форм кислорода) и перекисное окисление липидов. Опухоли печени и почек также могут быть следствием апоптоза FB 1 . В ответ на это может произойти непрерывная регенерация клеток, вызывающая рак. По-видимому, причиной канцерогенности, вызванной FB 1 , является нарушение метаболизма сфинголипидов , как и в случае с токсическими эффектами. [7] На основании всех этих исследований на животных FB 1 классифицирован Международным агентством по изучению рака (IARC) как потенциально канцерогенный для человека (Группа 2B). [24]
Отек легких у свиней, вызванный FB 1, интенсивно изучается после первого сообщения в 1981 году о свиньях с отеком легких после воздействия кукурузы, зараженной F. verticillioides . Сообщается об изменении биосинтеза сфинголипидов, особенно в тканях легких, сердца, почек и печени. Летальный отек легких развивался через 4–7 дней после приема корма с концентрацией ФБ 1 >16 мг/кг массы тела (>92 частей на миллион). Дозы 10 частей на миллион вызывали более легкую форму отека легких. [7]
Лейкоэнцефаломаляция – нейротоксическое заболевание лошадей. Вспышки этого заболевания в 20 веке стали результатом ряда исследований. По-видимому, причиной этого заболевания был FB 1 . Были выявлены повышенные уровни ферментов в сыворотке крови, что указывает на поражение печени. Обычно они наблюдались по повышению соотношения сфинганин/сфингозин. FB 1, возможно, индуцирует сердечно-сосудистую функцию из-за повышенного соотношения сфинганин/сфингозин. Это может быть одним из основных факторов, вызывающих лейкоэнцефаломаляцию. [25]
Эффектом кормления крыс FB 1 в течение периода до 90 дней обычно была нефротоксичность. У разных линий крыс чувствительность к FB 1 различалась. В почках основным эффектом был апоптоз. Также сообщалось об атрофии и регенерации канальцев, а также об уменьшении массы почек. [7] Сообщалось о гистопатологическом воздействии на печень крыс как после кратковременного, так и после длительного воздействия. Основной причиной был апоптоз. Мыши, по-видимому, не очень чувствительны к нефротоксическим эффектам по сравнению с крысами. В почках мышей при воздействии высоких доз наблюдались небольшие гистологические изменения. Печень также была основным органом-мишенью у мышей. Патология аналогична крысиной, с апоптозом и гепатоцеллюлярной гиперплазией. [7] Фумонизин B 1 , возможно, эмбриотоксичен, если доза токсична для матери. Ряд исследований генотоксичности не выявил мутагенетических эффектов. Хотя фумонизин может повредить ДНК напрямую, производя активные формы кислорода. [7] Мышиные эмбрионы подвергались воздействию FB 1 , и у них наблюдалось ингибирование синтеза и роста сфинголипидов. Это вызвало дефекты нервной трубки. Поглощение фолиевой кислоты резко подавлялось. Лечение после воздействия фолиевой кислотой уменьшало дефекты нервной трубки на 50–65%. [7]
Риски фумонизина B1 были оценены Международной программой по химической безопасности Всемирной организации здравоохранения и Научным комитетом по пищевым продуктам Европейской комиссии. Они определили переносимую суточную дозу FB1, FB2, FB3 отдельно или в комбинации в размере 2 мкг/кг массы тела. [16]
Считается , что ингибирование церамидсинтазы FB -1 обратимо, поскольку связывание формируется за счет нековалентных взаимодействий. Факторами, которые, вероятно, будут вызывать эту обратимость, являются снижение клеточной концентрации FB 1 и увеличение клеточных концентраций субстратов церамидсинтазы. [14] Кроме того, на детоксикацию влияет скорость удаления накопленных сфинганина и сфингозина. Сведения о метаболизме и биотрансформации FB 1 очень скудны. Однако метаболизм, скорее всего, происходит в кишечнике, поскольку частично гидролизованный и полностью гидролизованный FB 1 обнаруживался в фекалиях, но не в желчи верветок. [9] Биодоступность FB 1 можно снизить, обработав зараженную фумонизином кукурузу глюкоманнанами, экстрагированными из клеточной стенки дрожжей Saccharomyces cerevisiae. Эти полисахариды способны связывать определенные микотоксины и обладают 67%-ной способностью связывания фумонизинов. [26]
{{cite journal}}: Требуется цитировать журнал |journal=( помощь ){{cite journal}}: Требуется цитировать журнал |journal=( помощь ){{cite journal}}: Требуется цитировать журнал |journal=( помощь ){{cite journal}}: Требуется цитировать журнал |journal=( помощь )