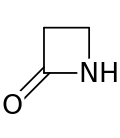
Кольцо β-лактама ( бета- лактама ) представляет собой четырехчленный лактам . [1] Лактам представляет собой циклический амид , а бета -лактамы так называются, потому что атом азота присоединен к β- атому углерода относительно карбонила. Самый простой возможный β-лактам — 2-азетидинон. β-лактамы являются важными структурными единицами лекарственных средств, что проявляется во многих β-лактамных антибиотиках . [2] До 1970 года большинство исследований β-лактамов было связано с группами пенициллина и цефалоспорина , но с тех пор было описано большое разнообразие структур. [3] [4]

Кольцо β-лактама является частью основной структуры нескольких семейств антибиотиков , основными из которых являются пенициллины , цефалоспорины , карбапенемы и монобактамы , которые поэтому также называются антибиотиками β-лактама . Почти все эти антибиотики работают, ингибируя биосинтез клеточной стенки бактерий . Это оказывает летальное воздействие на бактерии , хотя любая данная популяция бактерий, как правило, содержит подгруппу, которая устойчива к антибиотикам β-лактама. Бактериальная резистентность возникает в результате экспрессии одного из многих генов для производства β-лактамаз , класса ферментов, которые разрывают кольцо β-лактама. Более 1800 различных ферментов β-лактамаз были зарегистрированы у различных видов бактерий. [5] Эти ферменты сильно различаются по своей химической структуре и каталитической эффективности. [6] Когда в бактериальных популяциях есть эти резистентные подгруппы, лечение β-лактамом может привести к тому, что резистентный штамм станет более распространенным и, следовательно, более вирулентным. Антибиотики, полученные из β-лактама, можно считать одним из самых важных классов антибиотиков, но они склонны к клинической резистентности. β-лактам проявляет свои антибиотические свойства, имитируя природный субстрат d-Ala-d-Ala для группы ферментов, известных как пенициллинсвязывающие белки (PBP), функция которых заключается в сшивании пептидогликановой части клеточной стенки бактерий. [7]
Кольцо β-лактама также содержится в некоторых других препаратах, таких как ингибитор абсорбции холестерина эзетимиб .
Первый синтетический β-лактам был получен Германом Штаудингером в 1907 году путем реакции основания Шиффа анилина и бензальдегида с дифенилкетеном [8] [9] в реакции [2+2] -циклоприсоединения (Ph обозначает фенильную функциональную группу) :
Разработано много методов синтеза β-лактамов. [10] [11] [12]
Синтез β-лактама Брекпота [ 13] производит замещенные β-лактамы путем циклизации эфиров бета-аминокислот с использованием реагента Гриньяра . [14] Реагент Мукаямы также используется в модифицированном синтезе Брекпота. [13]
Из-за напряжения кольца β-лактамы легче гидролизуются , чем линейные амиды или более крупные лактамы. Это напряжение еще больше увеличивается за счет слияния со вторым кольцом, как это обнаружено в большинстве антибиотиков β-лактамов. Эта тенденция обусловлена тем, что амидный характер β-лактама восстанавливается из- за апланарности системы. Атом азота идеального амида sp 2 -гибридизован из-за резонанса , а sp 2 -гибридизованные атомы имеют тригональную плоскую геометрию связи . Поскольку пирамидальная геометрия связи навязывается атому азота напряжением кольца, резонанс амидной связи восстанавливается, и карбонил становится более кетонным . Нобелевский лауреат Роберт Бернс Вудворд описал параметр h как меру высоты тригональной пирамиды, определяемой азотом (как вершиной ) и тремя соседними с ним атомами. h соответствует прочности связи β-лактама, причем более низкие числа (более плоские; более похожие на идеальные амиды) являются более прочными и менее реактивными. [15] Монобактамы имеют значения h между 0,05 и 0,10 ангстрем (Å). Цефемы имеют значения h в диапазоне 0,20–0,25 Å. Пенамы имеют значения в диапазоне 0,40–0,50 Å, в то время как карбапенемы и клавамы имеют значения 0,50–0,60 Å, являясь наиболее реактивными из β-лактамов по отношению к гидролизу. [16]