
Бета -шпилька (иногда также называемая бета-лентой или бета-бета-единицей ) — это простой структурный мотив белка, включающий две бета-нити , которые выглядят как шпилька . Мотив состоит из двух нитей, которые соседствуют в первичной структуре , ориентированы в антипараллельном направлении ( N-конец одного листа соседствует с C-концом следующего) и связаны короткой петлей из двух-пяти аминокислот . Бета-шпильки могут встречаться изолированно или как часть серии водородно-связанных нитей, которые вместе составляют бета-лист .
Такие исследователи, как Франциско Бланко и др., использовали ЯМР белков , чтобы показать, что бета-шпильки могут образовываться из изолированных коротких пептидов в водном растворе, предполагая, что шпильки могут образовывать центры нуклеации для сворачивания белков . [1]
Бета-шпильки изначально классифицировались исключительно по количеству аминокислотных остатков в их петлевых последовательностях, поэтому их называли одноостаточными, двухостаточными и т. д. [2] Однако эта система несколько двусмысленна, поскольку не учитывает, связаны ли остатки, которые сигнализируют о конце шпильки, одинарными или двойными водородными связями друг с другом. С тех пор Милнер-Уайт и Поэт предложили улучшенный способ классификации. [3] Бета-шпильки делятся на четыре отдельных класса, как показано на рисунке 1 публикации. Каждый класс начинается с наименьшего возможного количества остатков петли и постепенно увеличивает размер петли путем удаления водородных связей в бета-слое. Первичная шпилька класса 1 представляет собой петлю из одного остатка, где связанные остатки имеют две водородные связи. Затем удаляется одна водородная связь, чтобы создать петлю из трех остатков, которая является вторичной шпилькой класса 1. Остатки с одинарной связью подсчитываются в последовательности петли, но также сигнализируют о конце петли, таким образом определяя эту шпильку как петлю из трех остатков. Затем эта одинарная водородная связь удаляется, чтобы создать третичную шпильку; петлю из пяти остатков с дважды связанными остатками. Этот шаблон продолжается бесконечно и определяет все бета-шпильки в пределах класса. Класс 2 следует той же схеме, начиная с петли из двух остатков с конечными остатками, которые разделяют две водородные связи. Класс 3 начинается с трех остатков, а класс 4 — с четырех остатков. Класс 5 не существует, поскольку эта первичная шпилька уже определена в классе 1. Pi Эта схема классификации не только учитывает различные степени водородных связей, но и говорит кое-что о биологическом поведении шпильки. Замены отдельных аминокислот могут разрушить определенную водородную связь, но не разворачивают шпильку или не изменяют ее класс. С другой стороны, вставки и удаления аминокислот должны будут развернуть и реформировать всю бета-цепь , чтобы избежать бета-выпуклости во вторичной структуре. Это изменит класс шпильки в процессе. Поскольку замены являются наиболее распространенными мутациями аминокислот, белок потенциально может претерпеть преобразование, не влияя на функциональность бета-шпильки. [3]
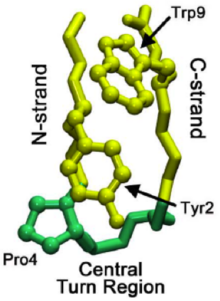

Понимание механизма, посредством которого сворачиваются микродомены, может помочь пролить свет на закономерности сворачивания целых белков . Исследования бета-шпильки, называемой хиньолином (см. хиньолин на Proteopedia), выявили пошаговый процесс сворачивания, который управляет сворачиванием бета-шпильки. Эта шпилька имеет особенности последовательности, схожие с более чем 13 000 известных шпилек, и, таким образом, может служить более общей моделью для формирования бета-шпильки. Формирование области нативного поворота сигнализирует о начале каскада сворачивания, где нативный поворот — это тот, который присутствует в конечной сложенной структуре.
При сворачивании всех белков поворот может начинаться не в нативной области поворота, а в С-цепи бета-шпильки. Затем этот поворот распространяется по С-цепи (бета-цепи, ведущей к С-концу), пока не достигнет нативной области поворота. Иногда взаимодействия остатков , ведущие к нативной области поворота, слишком сильны, что приводит к обратному распространению. Однако, как только нативная область поворота формируется, взаимодействия между пролинами и остатками триптофана (показано на изображении справа) в этой области помогают стабилизировать поворот, предотвращая «откат» или растворение.
Исследователи полагают, что повороты не возникают в N-цепи из-за повышенной жесткости (часто вызванной пролином, ведущим к нативной области поворота) и меньшего количества конформационных вариантов. Первоначальное формирование поворота происходит примерно за 1 мкс. После того, как начальный поворот установлен, были предложены два механизма относительно того, как сворачивается остальная часть бета-шпильки: гидрофобный коллапс с перестройками на уровне боковой цепи или более общепринятый механизм типа застежки-молнии. [4]
Мотив петли β-шпильки можно найти во многих макромолекулярных белках. Однако небольшие и простые β-шпильки могут существовать и сами по себе. Чтобы наглядно это увидеть, слева в качестве примера показан белок домена Pin1 .
Белки, богатые β-слоями, также называемые доменами WW , функционируют, прикрепляясь к богатым пролином и/или фосфорилированным пептидам для опосредования белок-белковых взаимодействий . «WW» относится к двум остаткам триптофана (W), которые сохраняются в последовательности и помогают в сворачивании β-слоев для получения небольшого гидрофобного ядра. [5] Эти остатки триптофана можно увидеть ниже (справа) красным цветом.
Этот фермент связывает свой лиганд посредством сил Ван-дер-Ваальса консервативных триптофанов и богатых пролином областей лиганда. Другие аминокислоты затем могут связываться с гидрофобным ядром структуры β-шпильки, чтобы обеспечить надежное связывание. [6]
Также часто можно обнаружить остатки пролина в фактической части петли β-шпильки, поскольку эта аминокислота жесткая и способствует образованию "поворота". Эти остатки пролина можно увидеть в виде красных боковых цепей на изображении домена Pin1 WW ниже (слева).
Разработка пептидов, которые принимают структуру β-шпильки (без опоры на связывание металлов, необычные аминокислоты или дисульфидные сшивки), достигла значительного прогресса и дала представление о динамике белков. В отличие от α-спиралей , β-шпильки не стабилизируются обычным паттерном водородных связей. В результате ранние попытки требовали по крайней мере 20–30 аминокислотных остатков для достижения стабильных третичных складок β-шпилек. Однако этот нижний предел был снижен до 12 аминокислот за счет повышения стабильности, обеспечиваемого включением пар перекрестных нитей триптофан-триптофан. Было показано, что две пары триптофана, не связывающиеся водородом, сцепляются в мотив, похожий на молнию, стабилизируя структуру β-шпильки, при этом позволяя ей оставаться водорастворимой . Структура ЯМР β -пептида триптофановой молнии (trpzip) показывает стабилизирующий эффект благоприятных взаимодействий между соседними индольными кольцами. [7]

Синтез пептидов trpzip β-шпилек включает фотопереключатели, которые облегчают точный контроль над сворачиванием. Несколько аминокислот в повороте заменяются азобензолом , который может быть вызван для переключения из транс- в цис-конформацию светом с длиной волны 360 нм. Когда фрагмент азобензола находится в цис-конформации, аминокислотные остатки правильно выравниваются, чтобы принять формирование β-шпильки. Однако транс-конформация не имеет надлежащей геометрии поворота для β-шпильки. [8] Это явление можно использовать для исследования конформационной динамики пептида с помощью фемтосекундной абсорбционной спектроскопии. [8]