Автоматизированный патч-кламп начинает [1] заменять ручной патч-кламп как метод измерения электрической активности отдельных клеток . Для автоматизации регистрации патч-кламп клеток в клеточной культуре и in vivo используются различные методы . Эта работа ведется с конца 1990-х годов исследовательскими лабораториями и компаниями, которые пытаются снизить сложность и стоимость ручного патч-клампинга. Долгое время патч-кламп считался формой искусства и по-прежнему остается очень трудоемким и утомительным, особенно in vivo. Методы автоматизации пытаются уменьшить ошибки пользователей и изменчивость при получении качественных электрофизиологических записей от отдельных клеток.
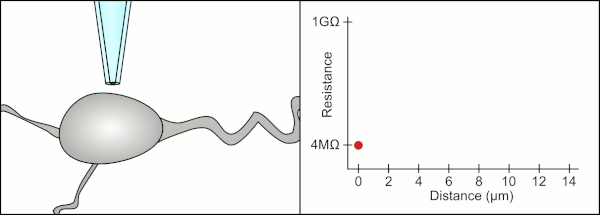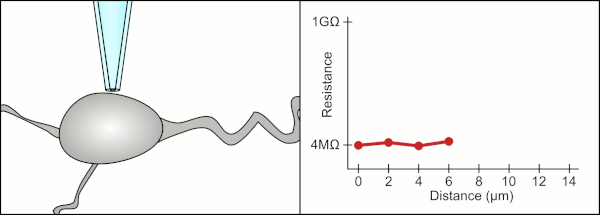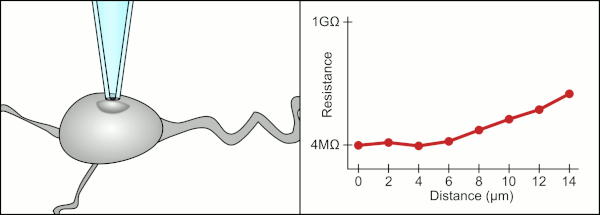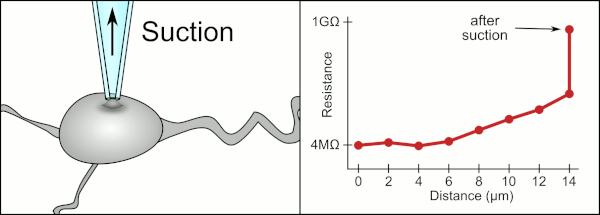
Традиционный ручной метод патч-клампа с использованием стеклянных пипеток был разработан Эрвином Неером и Бертом Сакманном и требовал высококвалифицированного техника. Техник располагал стеклянную пипетку около клетки и применял соответствующее всасывание для создания электрического уплотнения между пипеткой и клеточной мембраной. Это уплотнение обеспечивает качественную запись, предотвращая утечку тока между кончиком пипетки и клеточной мембраной. Это уплотнение создается, когда мембрана клетки химически связывается с кончиком пипетки, так что внутренняя часть пипетки соединяется только с цитоплазмой клетки . Это соединение или уплотнение мембраны со стеклом называется «гигасеалом». [2]
Традиционно техник использовал свой рот, чтобы обеспечить точное давление, необходимое для герметизации клетки. Помимо контроля давления, техник также должен расположить пипетку на точном правильном расстоянии от клетки, чтобы мембрана герметизировала ее. Используя микроманипулятор , пипетка перемещается к клетке до тех пор, пока техник не увидит изменение электрического сопротивления между жидкостью внутри пипетки и окружающей жидкостью (см. анимацию). Обычно для этого требуется 3–12 месяцев обучения, прежде чем техник сможет надежно записывать данные с клеток. Техник по сути выполняет балансировочный акт, пытаясь одновременно наблюдать и манипулировать несколькими системами (движение, давление и электрические сигналы). Если каждая часть процесса не будет выполнена точно и с правильным временем, уплотнение не будет сформировано должным образом, и техник должен будет заменить пипетку и начать все заново.
Эти проблемы сокращают количество записей, которые может получить техник, и значительно увеличивают стоимость. Автоматизация стремится сократить время, сложность и стоимость ручного патч-клампинга. Улучшение пропускной способности также будет иметь ключевое значение для обеспечения высокой пропускной способности патч-секвенирования для одновременного объединения электрофизиологии , морфологии и транскриптомных свойств нейронов в масштабе, сопоставимом с другими методами секвенирования [3]
Техника автоматизации варьируется в зависимости от окружающей среды клеток. Для клеток in vivo это обычно означает, что клетки находятся в мозге и окружены другими клетками. Эта среда также содержит кровеносные сосуды , дендриты , аксоны и глиальные клетки , которые затрудняют формирование гигасила путем засорения кончика пипетки диаметром 1-2 мкм. Здесь точный контроль давления и положения на кончике пипетки играет большую роль в предотвращении засорения и определении того, находится ли клетка вблизи кончика пипетки, как обсуждалось выше.
Клетки in vitro могут быть суспендированы в жидкости, прикреплены к чашке для культивирования или оставаться частью куска ткани, который был удален из животного. Эти среды, как правило, не должны компенсировать движение ткани из-за сердцебиения или дыхания животного. В случае клеток в суспензии пипетка полностью заменяется микрочипом с отверстиями, которые могут создавать гигасилы и измерять электрическую активность. Засорение также менее проблематично для клеток или тканей в чашках для культивирования, поскольку клетки и пипетку можно увидеть через микроскоп, что помогает лаборанту избегать всего, кроме интересующей клетки.
Каждая из этих автоматизированных систем должна выполнять несколько задач. Она должна располагать ячейку рядом с кончиком пипетки или другого устройства с отверстием 1-2 мкм, контролировать давление в отверстии и контролировать напряжение внутри ячейки.
Один из примеров in vivo патч-клампинга был продемонстрирован Кодандарамайей и др. [4] В этом случае контроль давления состоял из набора электронных клапанов и электронных регуляторов давления для обеспечения трех давлений, которые ранее обеспечивались техником (высокое давление 800–1000 мбар, низкое давление 20–30 мбар и небольшой вакуум 15–150 мбар). Три электронных клапана переключались между тремя давлениями и атмосферным давлением. Высокое давление использовалось для предотвращения засорения пипетки, низкое давление использовалось при поиске клеток, а вакуум использовался для облегчения процесса гигагерметизации. Все они контролировались компьютером для выбора между давлениями по мере изменения сопротивления на кончике пипетки.
Ручной контроль положения в этом случае был заменен пьезоэлектрическим микроманипулятором с компьютерным управлением , который перемещал пипетку дискретными шагами по 2-3 мкм в ткань, пока она не соприкоснулась с клеткой. Этот прецизионный контроль гораздо более точен и повторяем, чем ручное позиционирование, и не требует оператора.
Компьютер также вычисляет и отслеживает изменение электрического сопротивления, когда пипетка контактирует с клеткой. Он посылает сигнал напряжения в форме квадратной волны вниз по пипетке, который либо выходит из конца пипетки, либо блокируется клеточной мембраной. Когда мембрана блокирует его, компьютер останавливает движение пипетки и применяет всасывание для формирования гигасила. Такая автоматизация исключает необходимость принятия решений техником, и в отличие от техника компьютер может выполнять эти задачи неустанно и с большей точностью.
Все эти шаги выполняются в той же логической последовательности, что и ручная патч-кламп, но не требуют обширного обучения для выполнения и полностью контролируются компьютером. Это снижает расходы, необходимые для получения записей патч-кламп и повышает повторяемость и надежность записи в живом мозге.


Разработано много типов систем для патч-кламп-клеток в суспензионных культурах. Одна из систем использует традиционную пипетку и клетки в капельной суспензионной культуре для получения записей патч-кламп (см. рисунок). Это имеет дополнительное преимущество использования традиционных систем изготовления пипеток, которые нагревают стеклянный капилляр и вытягивают его в длину для создания конического наконечника, используемого в патч-кламп-клемпе.
Более распространенные системы автоматизации для суспензионных культур используют микрочипы с крошечными (1-2 мкм) отверстиями в плоской подложке вместо пипеток для создания гигасеала и записи с отдельных клеток. Патч-чипы были разработаны в начале 2000-х годов в результате усовершенствования технологий микропроизводства, разработанных полупроводниковой промышленностью. Чипы обычно изготавливаются из кремния , стекла , PDMS , полимида . Системы патч-чипов обычно более сложные и дорогие, но имеют дополнительное преимущество параллельной и бесконтактной работы. [5] [6] [7]
Обычно нейроны не растут в суспензионных культурах, но другие типы клеток могут. Некоторые из них могут быть трансфицированы генами для создания интересующих мембранных ионных каналов . Это означает, что клетка, которая обычно не имеет электрической активности, может выращивать ионные каналы в своей мембране, которые будут генерировать ионные токи. Поскольку клетки диссоциированы друг от друга в суспензионных культурах, ионные токи в одной клетке могут быть измерены с точностью. Это позволяет исследователям изучать поведение ионных каналов в более контролируемых условиях без помех от токов от других клеток, как это обычно происходит в нейронных сетях. Это особенно полезно в исследованиях по скринингу лекарств, где целью является определенный белок. [8] Поскольку обработка клеток в суспензии намного проще, чем обработка клеток в культуре или in vivo, записи патч-кламп можно получить таким образом намного быстрее и надежнее, что повышает производительность, делая возможным скрининг тысяч соединений. [9]
Нейроны, полученные из стволовых клеток, культивируемых адгезивно, могут быть подняты в суспензию и успешно использованы в планарных устройствах с патч-клампом. [10] Ионные каналы, такие как потенциалзависимые натриевые каналы , потенциалзависимые калиевые каналы и ионотропные лигандзависимые ионные каналы, открытые лигандом ГАМК, были зарегистрированы в этих клетках с помощью автоматизированного и ручного патч-клампа. [11]
Существует множество методов in vitro для автоматизированного патч-клампинга культивируемых клеток или срезов мозговой ткани.
Один из них использует чип-патч, подобный тем, что обсуждались выше, вместе с обработкой поверхности, которая заставляет культивируемые клетки мигрировать к отверстиям, где по мере их роста формируется гигасей. [12] Позволяя нейронам расти в культуре, они спонтанно образуют сети, подобные тем, что существуют в мозге, который больше похож на естественные ткани, чем на изолированные клетки в суспензии.
В другом методе клетки извлекаются из животного и культивируются на патч-чипе в течение 2–4 часов, в течение которых они спонтанно образуют гигасеалы с полиимидными и PDMS- патч-чипами [13]. Эта система не требует внешнего оборудования для формирования гигасеалов.
Другая техника автоматизирует позиционирование клеток с патч-клампом в культурах. Она использует нанопипетку на точном пьезоприводном столике для сканирования поверхности внутри чашки для культивирования. Во время сканирования она поддерживает постоянную электрическую емкость между кончиком пипетки и поверхностью или клетками под ней, перемещая ее вверх и вниз. (По мере приближения к клетке емкость увеличивается, поэтому привод отодвигает пипетку, и наоборот.) Это дает точное топографическое отображение поверхности внутри чашки для культивирования. После того, как клетки были отображены, компьютер перемещает пипетку к выбранной ячейке и опускает ее, чтобы сформировать с ней гигасил. [14]
Другая техника просто автоматизирует процесс тщательного контакта с клетками. Оператор помещает пипетку над образцом, а затем позволяет автоматизированному программному обеспечению взять на себя управление, опуская пипетку и пытаясь обнаружить увеличение сопротивления пипетки при ее контакте с клеткой. На этом этапе процесс заканчивается, и техник вручную создает гигасил.
Инструменты автоматизации пэтч-кламп стали коммерчески доступны в 2003 году. Из-за изначально высокой стоимости эта почти 20-летняя технология изначально предназначалась для биотехнологической и фармацевтической промышленности, но с тех пор она также использовалась в академических кругах и некоммерческих учреждениях, в сочетании и сосуществовании с другими связанными или дополнительными технологиями и методами. [15] Принятие и признание автоматизированной электрофизиологии пэтч-кламп отразилось в росте научной литературы, опубликованной с использованием этой технологии [16]