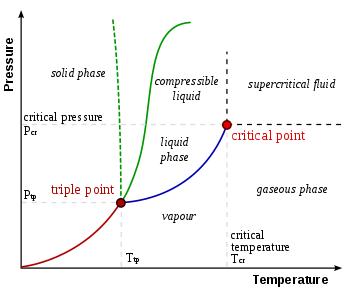
В термодинамике тройная точка вещества — это температура и давление , при которых три фазы ( газ , жидкость и твёрдое тело ) этого вещества сосуществуют в термодинамическом равновесии . [1] Это температура и давление, при которых встречаются кривые сублимации , плавления и испарения . Например, тройная точка ртути находится при температуре -38,8 °C (-37,8 ° F ) и давлении 0,165 мПа .
В дополнение к тройной точке для твердой, жидкой и газообразной фаз, тройная точка может включать более одной твердой фазы для веществ с несколькими полиморфами . Гелий-4 необычен тем, что у него нет кривой сублимации/осаждения и, следовательно, нет тройных точек, где его твердая фаза встречается с газовой фазой. Вместо этого у него есть точка пар-жидкость- сверхтекучая , точка твердое тело-жидкость-сверхтекучая, точка твердое тело-твердое тело-жидкость и точка твердое тело-твердое тело-сверхтекучая. Ни одну из них не следует путать с точкой Лямбда , которая не является какой-либо тройной точкой.
Термин «тройная точка» был придуман в 1873 году Джеймсом Томсоном , братом лорда Кельвина . [2] Тройные точки нескольких веществ используются для определения точек в международной шкале температур ITS-90 , начиная от тройной точки водорода (13,8033 К) до тройной точки воды (273,16 К, 0,01 °C или 32,018 °F).
До 2019 года тройная точка воды использовалась для определения кельвина , базовой единицы термодинамической температуры в Международной системе единиц (СИ). [3] Кельвин был определен таким образом, что тройная точка воды составляет ровно 273,16 К, но это изменилось с пересмотром СИ 2019 года , когда кельвин был переопределен таким образом, что постоянная Больцмана составляет ровно1,380 649 × 10−23 Дж⋅К −1 , и тройная точка воды стала экспериментально измеренной константой.

После пересмотра СИ в 2019 году значение тройной точки воды больше не используется в качестве определяющей точки. Однако ее эмпирическое значение остается важным: уникальное сочетание давления и температуры, при котором жидкая вода , твердый лед и водяной пар сосуществуют в устойчивом равновесии, приблизительно равно273,16 ± 0,0001 К [4] и давление пара 611,657 паскалей (6,11657 мбар; 0,00603659 атм). [5] [6]
Жидкая вода может существовать только при давлениях, равных или превышающих тройную точку. Ниже этого значения, в вакууме космического пространства , твердый лед сублимируется , переходя непосредственно в водяной пар при нагревании при постоянном давлении. И наоборот, выше тройной точки твердый лед сначала плавится в жидкую воду при нагревании при постоянном давлении, затем испаряется или кипит, образуя пар при более высокой температуре.
Для большинства веществ тройная точка газ-жидкость-твердое тело является минимальной температурой, при которой может существовать жидкость. Для воды это не так. Температура плавления обычного льда уменьшается с давлением, как показано пунктирной зеленой линией на фазовой диаграмме . Чуть ниже тройной точки сжатие при постоянной температуре преобразует водяной пар сначала в твердое тело, а затем в жидкость.
Исторически, во время миссии Mariner 9 на Марс , давление тройной точки воды использовалось для определения «уровня моря». Теперь для определения высоты Марса предпочитают использовать лазерную альтиметрию и гравитационные измерения. [7]
При высоких давлениях вода имеет сложную фазовую диаграмму с 15 известными фазами льда и несколькими тройными точками, включая 10, координаты которых показаны на диаграмме. Например, тройная точка при 251 К (−22 °C) и 210 МПа (2070 атм) соответствует условиям сосуществования льда Ih (обычного льда), льда III и жидкой воды, все в равновесии. Существуют также тройные точки сосуществования трех твердых фаз, например льда II , льда V и льда VI при 218 К (−55 °C) и 620 МПа (6120 атм).
Для тех форм льда высокого давления, которые могут существовать в равновесии с жидкостью, диаграмма показывает, что точки плавления увеличиваются с давлением. При температурах выше 273 К (0 °C) увеличение давления водяного пара приводит сначала к жидкой воде, а затем к форме льда высокого давления. В диапазонеПри температуре 251–273 К сначала образуется лед I, затем жидкая вода, затем лед III или лед V, а затем другие, еще более плотные формы высокого давления.

Ячейки с тройной точкой используются при калибровке термометров . Для точной работы ячейки с тройной точкой обычно заполняются химическим веществом высокой чистоты, таким как водород, аргон, ртуть или вода (в зависимости от желаемой температуры). Чистота этих веществ может быть такой, что только одна часть на миллион является загрязняющей примесью, называемой «шесть девяток», потому что она имеет чистоту 99,9999%. Используется определенный изотопный состав (для воды, VSMOW ), потому что изменения в изотопном составе вызывают небольшие изменения в тройной точке. Ячейки с тройной точкой настолько эффективны для достижения высокоточных, воспроизводимых температур, что международный стандарт калибровки для термометров, называемый ITS–90, опирается на ячейки с тройной точкой водорода , неона , кислорода , аргона , ртути и воды для разграничения шести своих определенных температурных точек.
В этой таблице перечислены тройные точки газ-жидкость-твердое тело нескольких веществ. Если не указано иное, данные получены из Национального бюро стандартов США (теперь NIST , Национальный институт стандартов и технологий). [9]
Примечания: