
Азометин-илиды представляют собой 1,3-диполи на основе азота , состоящие из иминиевого иона рядом с карбанионом . Они используются в реакциях 1,3-диполярного циклоприсоединения для образования пятичленных гетероциклов , включая пирролидины и пирролины . [1] [2] [3] Эти реакции являются высокостерео- и региоселективными и обладают потенциалом для образования четырех новых смежных стереоцентров. Таким образом, азометин -илиды имеют высокую полезность в общем синтезе и образовании хиральных лигандов и фармацевтических препаратов . Азометин-илиды могут быть получены из многих источников, включая азиридины, имины и иминии. Они часто генерируются in situ и немедленно реагируют с диполярофилами.
Резонансные структуры ниже показывают 1,3-дипольный вклад, в котором два атома углерода, соседствующие с азотом, имеют отрицательный или положительный заряд. [1] Наиболее распространенным представлением азометин-илидов является то, в котором азот заряжен положительно, а отрицательный заряд разделен между двумя атомами углерода. Относительные вклады различных резонансных структур зависят от заместителей на каждом атоме. Углерод, содержащий электроноакцепторные заместители, будет иметь более частичный отрицательный заряд из-за способности близлежащей электроноакцепторной группы стабилизировать отрицательный заряд.
Возможны три различные формы илида, каждая из которых приводит к различной стереохимии в продуктах реакций 1,3-диполярного циклоприсоединения . Возможны W-образные, U-образные и S-образные илиды. [1] W- и U-образные илиды, в которых заместители R находятся на одной стороне, приводят к продуктам син- циклоприсоединения, тогда как S-образные илиды приводят к анти -продуктам. В приведенных ниже примерах то, где заместитель R 3 оказывается в продукте, зависит от стерической и электронной природы заместителя (см. региоселективность 1,3-диполярных циклоприсоединений ). Стереохимия R 1 и R 2 в продукте циклоприсоединения выводится из диполя. Стереохимия R 3 выводится из диполярофила — если диполярофил более чем монозамещен (и прохирален ), в продукте может образоваться до четырех новых стереоцентров.

Азометинилиды могут быть получены путем раскрытия кольца азиридинов . [4] [5] В соответствии с правилами Вудворда-Хоффмана , тепловое раскрытие четырехэлектронного кольца происходит посредством конротационного процесса, тогда как фотохимическая реакция является дисротационной.

В этой реакции раскрытия кольца возникает проблема торквоселективности . Электроотрицательные заместители предпочитают вращаться наружу, в ту же сторону, что и заместитель R на азоте, тогда как электроположительные заместители предпочитают вращаться внутрь. [6]
Обратите внимание, что в случае азиридинов раскрытие кольца может привести к образованию другого 1,3-диполя , в котором разрывается связь C–N (а не связь C–C). [7]

Один из самых простых методов образования азометин-илидов — конденсация альдегида с амином . Если амин содержит электроноакцепторную группу на альфа-углероде, например, сложный эфир , депротонирование происходит легко. Возможным недостатком использования этого метода является то, что сложный эфир оказывается в продукте циклоприсоединения. Альтернативой является использование карбоновой кислоты , которую можно легко удалить в процессе циклоприсоединения путем декарбоксилирования . [8]

Азометинилиды также могут быть образованы непосредственно путем депротонирования иминий.
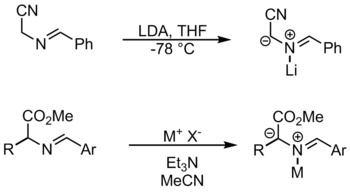
Металлические реагенты, используемые в этой реакции, включают бромистый литий и ацетат серебра . [1] В этом методе металл координируется с азотом, чтобы активировать субстрат для депротонирования. Другой способ образования азометин-илидов из иминов — прототропия и алкилирование .
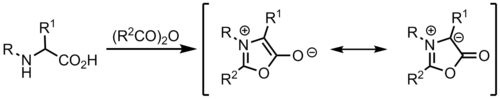
Илиды могут быть образованы из мюнхнонов , которые являются мезоионными гетероциклами и действуют как циклические азометиновые илиды. [9]

Как и в случае с другими реакциями циклоприсоединения 1,3-диполя с π-системой, 1,3-диполярное циклоприсоединение с использованием азометин-илида является шестиэлектронным процессом. Согласно правилам Вудворда–Хоффмана , это присоединение является супрафациальным по отношению как к диполю, так и к диполярофилу . Реакция обычно рассматривается как согласованная , в которой две связи углерод-углерод образуются одновременно, но асинхронно. Однако, в зависимости от природы диполя и диполярофила, возможны дирадикальные или цвиттерионные промежуточные продукты. [10] Эндопродукт , как правило, предпочтителен, как и в изоэлектронной реакции Дильса–Альдера . В этих реакциях азометиновый илид обычно является HOMO , а электронодефицитный диполярофил — LUMO, хотя известно, что происходят реакции циклоприсоединения с неактивированными π-системами, особенно когда циклизация является внутримолекулярной. [11] Для обсуждения теории пограничных молекулярных орбиталей 1,3-диполярных циклоприсоединений см. 1,3-диполярное циклоприсоединение#Теория пограничных молекулярных орбиталей .
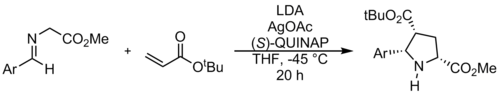
Реакции 1,3-диполярного циклоприсоединения азометин-илидов обычно используют алкены или алкины в качестве диполярофилов для образования пирролидинов или пирролинов соответственно. Реакция азометин-илида с алкеном показана выше и приводит к образованию пирролидина. [12] Этот тип реакций может быть использован для синтеза уллазина. [13] Хотя диполярофилы обычно являются α,β-ненасыщенными карбонильными соединениями, в последнее время было достигнуто много успехов в разработке новых типов диполярофилов. [14]
Когда диполь и диполярофил являются частью одной и той же молекулы, внутримолекулярная реакция циклизации может привести к полициклическому продукту значительной сложности. [1] Если диполярофил связан с углеродом диполя, образуется конденсированный бицикл. Если он связан с азотом, получается мостиковая структура. Внутримолекулярная природа реакции также может быть полезна, поскольку региоселективность часто ограничена. Еще одним преимуществом внутримолекулярных реакций является то, что диполярофил не обязательно должен быть электронодефицитным — сообщалось о многих примерах реакций циклизации с богатыми электронами, алкилзамещенными диполярофилами, включая синтез мартинелловой кислоты, показанный ниже.
В отличие от большинства реакций 1,3-диполярного циклоприсоединения, в которых стереохимия диполя теряется или отсутствует, азометин-илиды способны сохранять свою стереохимию. Обычно это делается путем раскрытия кольца азиридина и последующего захвата диполярофилом до того, как стереохимия сможет измениться.
Как и другие реакции 1,3-диполярного циклоприсоединения, циклоприсоединения азометин-илида могут образовывать эндо- или экзопродукты. Эту селективность можно настроить с помощью металлического катализа. [15] [16]
Энантиоселективное циклоприсоединение азометин-илидов с использованием хиральных катализаторов было впервые описано в основополагающей работе Оллвея и Григга в 1991 году. [17] Этот мощный метод был далее разработан Йоргенсеном и Чжаном. В этих реакциях обычно используются комплексы цинка , серебра , меди , никеля и кальция .
Используя хиральные фосфиновые катализаторы , можно синтезировать энантиомерно чистые спироиндолиноны. Метод, описанный Гонгом и др., приводит к неожиданному региохимическому результату, который не следует за электронными эффектами. Это объясняется благоприятным пи-стекингом с катализатором. [18]
Сопряженные азометин-илиды способны к [1,5]- и [1,7] -электроциклизации . [19] Пример [1,7]-электроциклизации дифенилэтенилзамещенного азометин-илида показан ниже. Это конротаторное закрытие кольца сопровождается супрафациальным [1,5]-гидридным сдвигом, который дает реароматизированный продукт. Стерика и геометрия реагирующего фенильного кольца играют важную роль в успешности реакции. [20]

Соединения, полученные в результате этого типа электроциклизации, использовались в качестве диенов в реакциях Дильса-Альдера для присоединения соединений к фуллеренам . [21]

Циклоприсоединение азометин-илида с неактивированным алкеном было использовано в общем синтезе мартинелловой кислоты. Этап циклоприсоединения образовал два кольца, включая пирролидин , и два стереоцентра. [22]

В синтезе спиротрипростатина B образуется азометиновый илид из конденсации амина с альдегидом . Затем илид реагирует с электронодефицитным алкеном на индолиноне, что приводит к образованию спироциклического пирролидина и четырех смежных стереоцентров. [23]
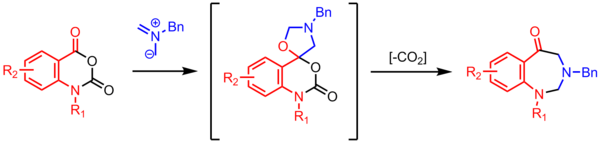
Циклизация азометин-илида с карбонилом дает спироциклический оксазолидин , который теряет CO2 , образуя семичленное кольцо. Эти высокоэффективные декарбоксилирующие многоступенчатые реакции распространены в химии азометин-илида. [24]