
Сонодинамическая терапия (СДТ) — это неинвазивное лечение, часто используемое для облучения опухолей, которое использует соносенсибилизатор и глубокое проникновение ультразвука для лечения поражений различной глубины путем уменьшения количества целевых клеток и предотвращения будущего роста опухоли. [1] [2] Многие существующие стратегии лечения рака вызывают системную токсичность или не могут проникнуть в ткань достаточно глубоко, чтобы достичь всей опухоли; однако появляющиеся методы ультразвуковой стимуляции могут стать альтернативой этим методам лечения с их повышенной эффективностью, большей глубиной проникновения и сниженными побочными эффектами. Сонодинамическая терапия может использоваться для лечения рака и других заболеваний, таких как атеросклероз, и снизить риск, связанный с другими стратегиями лечения, поскольку она вызывает цитотоксические эффекты только при внешней стимуляции ультразвуком и только в раковой области, в отличие от системного введения химиотерапевтических препаратов. [3] [4] [5]
.jpg/440px-Photodynamic_therapy_(2).jpg)
Активные формы кислорода (ROS) являются важным компонентом SDT, поскольку они обеспечивают цитотоксичность сонодинамической терапии; они вырабатываются, когда ультразвук сочетается с сенсибилизирующим препаратом и молекулярным кислородом. [1] Без ультразвука препарат не токсичен. Однако, как только препарат подвергается воздействию ультразвука и молекулярного кислорода, он становится токсичным. [1] Фотодинамическая терапия , от которой произошла сонодинамическая терапия, использует аналогичный механизм. Вместо ультразвука для активации препарата используется свет. [1] SDT позволяет ультразвуку проникать глубже в ткань (примерно до 30 сантиметров) по сравнению с фотодинамической терапией (PDT), поскольку он может быть высокофокусированным. [1] Эта увеличенная глубина проникновения в конечном итоге означает, что SDT может использоваться для лечения более глубоких, менее доступных опухолей и является более экономически эффективной, чем PDT. [6] [1] Фотодинамическая терапия может использоваться в сочетании с сонодинамической терапией и подробно описана в разделе «Применения» этой статьи. Сонодинамическая терапия может использоваться синергически с другими терапевтическими методами, такими как микропузырьки с лекарственной нагрузкой, наночастицы, экзосомы, липосомы и гены для повышения эффективности. В настоящее время SDT не имеет никаких клинических продуктов и действует как адъювант для вышеупомянутых терапевтических методов, но его изучали для использования при лечении атеросклероза и рака для уменьшения размера опухолей в груди, поджелудочной железе, печени и спинальных саркомах. [7] [3] [8] [9] [10] [11] [12] [13] [14] [15] [16]

Механизм действия сонодинамической терапии заключается в использовании низкоинтенсивного ультразвука посредством использования сфокусированных механических волн для создания цитотоксического эффекта. Однако сама по себе СДТ является нетермической, нетоксичной и способна неинвазивно проникать глубоко в ткани по сравнению с другими методами доставки, такими как фотодинамическая терапия. СДТ часто выполняется вместе с использованием соносенсибилизатора, такого как порфирин , фталоцианины , ксантены и противоопухолевые препараты. [17] Ультразвуковые волны также классифицируются как акустические волны, и их воздействие на ткань применения можно описать процессом, называемым кавитацией. Кавитация происходит как специфическое взаимодействие между ультразвуком и водной средой и заставляет пузырьки газа лопаться при воздействии определенных ультразвуковых параметров, тем самым способствуя проникновению терапевтического средства в биологические ткани путем создания полостей вблизи края мембраны. [18] [1] Кавитацию можно разбить на стабильную и инерционную кавитацию. При стабильной кавитации колебания газовых пузырьков вызывают перемешивание окружающей среды. [1] При инерционной кавитации газовые пузырьки увеличиваются в объеме и почти достигают своего резонансного объема, разбухая перед агрессивным схлопыванием. [1] Имплозия везикул приводит к резкому изменению температуры и давления, тем самым увеличивая проницаемость клеточной мембраны для различных лекарств. [1] [19] Микропузырьки создаются акустическими волнами от ультразвука, которые расширяются и схлопываются, высвобождая энергию, приводя соносенсибилизатор в возбужденное состояние и генерируя ROS. Кавитация этого газового пузырька может образовывать ROS с помощью различных методологий, таких как сонолюминесценция и пиролиз . [1] Апоптоз является результатом образования ROS и механических сил SDT посредством разрушения мембраны в процессе, называемом перекисным окислением липидов. Некроз также является потенциальным результатом SDT. [ необходима цитата ]
Влияние сонолюминесценции на SDT и ROS не было полностью изучено в литературе. [1] В настоящее время известно, что сонолюминесценция позволяет испускать свет при коллапсе пузырьков, что может активировать сенсибилизаторы. Исследование Хачимина и соавторов подчеркивает использование SDT в качестве метода активации низкочувствительного соносенсибилизатора, DCPH-P-Na(I), для рака, который находится слишком глубоко в ткани, чтобы бороться с использованием PDT без раздражения кожи. [1] [20] Пиролиз повышает окружающую температуру, усиливает процесс кавитации, разрушает сенсибилизатор, генерируя свободные радикалы, и свободные радикалы взаимодействуют в своей среде, генерируя ROS. [1] Для обоих методов была подчеркнута важность синглетного кислорода по сравнению с гидроксильным радикалом для индукции цитотоксичности. [1] [20] [21] В то время как другие исследования [1] [22] [23] обнаружили, что синглетный кислород не оказывает существенного эффекта. В целом, обе эти методологии не имеют достаточного охвата в литературе, чтобы полностью объяснить их роль в образовании ROS. Однако литература показала успех в их анализе и применении. [1] [4] [24]

В сонодинамической терапии существуют два основных механизма генерации ROS: сонолюминесценция и пиролиз. [1] Сонолюминесценция происходит, когда ультразвук производит свет после облучения водного раствора [1] [25] Точный механизм, с помощью которого производится свет, остается неясным. Однако предполагается, что инерционная кавитация является ключевым элементом этого процесса. [1] [26] Другие исследования также указывают на потенциальную роль стабильной кавитации [1] [27]
Пиролиз, как полагают, происходит, когда инерционная кавитация вызывает экстремальное повышение температуры, разрушает соносенсибилизаторы, тем самым производя свободные радикалы, которые могут реагировать и в конечном итоге производить ROS, необходимые для SDT. [1] [28] Локальное повышение температуры способствует инерционной кавитации и разрушению соносенсибилизатора для создания ROS. Пиролиз внутри кавитационных пузырьков будет производить H+ и OH- посредством слабых связей внутри молекулы растворенного вещества. [1] [19]

В дополнение к химическим методам, механические свойства акустической волны, генерируемой ультразвуком, могут помочь в инициировании цитотоксических эффектов. Это происходит посредством разрушения мембраны гидрофобным соносенсибилизатором. Механическое разрушение мембраны вызывает процесс, называемый перекисным окислением липидов , а корректировки клеточной мембраны могут изменить проницаемость клеток для лекарственных препаратов. [1] [29] Как сонохимические, так и сономеханические методологии используются для генерации ROS и высвобождения груза из везикул для таких применений, как нацеливание на опухоли. [ необходима цитата ]
В предыдущей литературе было показано, что низкоинтенсивный ультразвук вызывает апоптотические эффекты в окружающих клетках. Было обнаружено, что не начальные ROS вызывают апоптоз в клетках, а свободные радикалы в митохондриях. В исследовании Хонды и др. было установлено, что путь митохондрии-каспазы отвечает за апоптоз через увеличение внутриклеточного кальция. [1] [30] Помимо апоптоза, вызванного ROS, кавитация является еще одним фактором, участвующим в апоптозе окружающих клеток. Оба типа кавитации способны вызывать апоптоз через повреждение мембраны. Такие условия, как частота, рабочий цикл, импульс и интенсивность, можно изменять для оптимизации условий гибели клеток, таких как некроз, лизис или апоптоз. [31] [24] [32]
Этот метод гибели клеток может происходить, когда клеточные органеллы попадают в аутофагосомы, которые объединяются с лизосомами. Продолжение этого процесса приведет к гибели клеток, и ингибиторы или промоторы аутофагии могут контролироваться, чтобы способствовать или препятствовать гибели клеток и поглощению химиотерапевтических препаратов. [1]
Соносенсибилизаторы или соносенсибилизирующие терапевтические средства являются основным элементом SDT и могут быть адаптированы для лечения различных видов рака и получения различных эффектов. [2] Эти терапевтические средства, часто включающие использование порфирина или ксантена, будут инициировать токсический эффект через ROS при воздействии ультразвука. [ необходима цитата ]

Сенсибилизаторы на основе порфирина, изначально использовавшиеся в качестве фотосенсибилизатора в ФДТ, представляют собой довольно гидрофобные молекулы, полученные из гематопорфирина. [1] Отдельные атомы кислорода или гидроксильные радикалы производятся сенсибилизаторами на основе порфирина при воздействии ультразвука или света, обеспечивая цитотоксические эффекты, желаемые при сонодинамической и фотодинамической терапии. [1] Однако результат сенсибилизаторов на основе порфирина не настолько локален, как хотелось бы при сонодинамической терапии, поскольку они также располагаются в нецелевой ткани между опухолью и излучателем ультразвука. [1]


Сенсибилизаторы на основе ксантена, с другой стороны, продемонстрировали успешную цитотоксичность in vitro, производя активные формы кислорода после активации ультразвуком. [1] Необходимы дополнительные исследования для улучшения его потенциальной эффективности in vivo, поскольку он быстро перерабатывается печенью и выводится из организма. [1] Розовый бенгальский — это широко используемый соносенсибилизатор на основе ксантена. [1]
Другие сенсибилизаторы, которые были исследованы на предмет их потенциала в сонодинамической терапии (и также использовались ранее в ФДТ), включают акридиновый оранжевый , метиленовый синий , куркумин и индоцианин зеленый . [1] Исследование Сузуки и соавторов использовало акридиновый оранжевый, флуоресцентный катионный краситель, который может встраиваться в нуклеиновые кислоты, для лечения клеток саркомы 180 ультразвуком и продемонстрировало, что активные формы кислорода являются критическим элементом СДТ, учитывая, что их отсутствие снижает эффективность СДТ. [33] Подобно предыдущему исследованию, недавнее исследование Комори и соавторов использовало ультразвук в сочетании с метиленовым синим (фенотиазиновый краситель, обычно используемый в ФДТ, который демонстрирует низкую токсичность) для облучения клеток саркомы 180 и обнаружило, что метиленовый синий является эффективным соносенсибилизатором в снижении жизнеспособности клеток. [34] Интересно, что куркумин — это специя, которая также может выступать в качестве сенсибилизатора для ФДТ и СДТ. [1] В исследовании Ваксмана и др. куркумин смог повлиять на макрофаги, которые важны для развития бляшек, обнаруженных у пациентов с атеросклерозом, тем самым уменьшая количество бляшек в модели животных. [35] Эти результаты наряду с другими исследованиями указывают на то, что сенсибилизаторы куркумина могут быть использованы в лечении рака с помощью СДТ. Индоцианин зеленый — это краситель, который поглощает ближние инфракрасные длины волн, и является еще одним сенсибилизатором, который, как было показано, снижает жизнеспособность клеток при сочетании с ультразвуком и/или светом. [36] Исследование in vivo продемонстрировало, что обработка мышиной модели опухоли индоцианином зеленым в сочетании с ультразвуком и светом привела к 98% уменьшению объема опухоли через 27 дней после лечения. [36]
Как упоминалось выше, соносенсибилизаторы часто используются в сочетании с различными носителями лекарственных средств, такими как микропузырьки, нанопузырьки, липосомы и экзосомы, для улучшения концентрации и проникновения терапевтического агента. [18]

Липосомы являются распространенным средством доставки лекарств, особенно для лечения рака. Липосомы содержат фосфолипидный бислой. Он распространен из-за своей способности проникать в протекающую сосудистую сеть и плохой лимфатический дренаж внутри опухолей для повышения удерживающей способности. [37] Эти носители лекарств могут инкапсулировать гидрофобные и липофильные молекулы в своем липидном бислое и могут быть получены естественным или синтетическим путем. [38] [39] Кроме того, липосомы могут захватывать гидрофильные молекулы в своем гидрофильном ядре. [38] По сравнению с распространенной химиотерапией при лечении рака, лекарства, загруженные в липосомы, позволяют снизить системную токсичность и потенциально повысить эффективность целевой доставки. [18] Успех липосом в качестве систем доставки лекарств был продемонстрирован как in vivo, так и in vitro. [38] Исследование Лю и др. показало, что липосомы можно использовать вместе с SDT для запуска высвобождения лекарств посредством окисления липидных компонентов. [40] Другое исследование Ниномии и соавторов использовало капли наноэмульсии, подвергнутые воздействию ультразвуковых волн для образования более крупных газовых пузырьков для разрушения липосомальной мембраны для высвобождения лекарства. Многие свойства и элементы липосом могут быть изменены для их конкретной цели и для повышения эффективности, в частности, их способность перемещаться в крови и взаимодействовать с клетками и тканями в организме. [38] Эти элементы включают их диаметр, заряд, расположение, а также состав их мембран. [38] Дай и соавторы предложили включение соносенсибилизаторов в липосомы для повышения целевой специфичности. [18] Поскольку SDT стимулирует раковые ткани поглощать и удерживать соносенсибилизаторы с последующей активацией экстракорпоральным ультразвуком, Дай и соавторы исследовали влияние инкапсулированных в липосомы лекарств на эффективность целевой доставки в SDT. Они обнаружили, что, в дополнение к удобству и практичности, SDT является безопасным и эффективным вариантом для лечения рака. [18]
Экзосомы — это наноносители, которые могут обеспечить целевую доставку лекарственных средств для усиления местных цитотоксических эффектов при минимизации любого системного воздействия. Они извлекаются из клеток и используются для транспортировки внутри клетки в виде связанных с мембраной везикул. Преимущества экзосом для доставки лекарств включают их способность к манипулированию и конструированию, а также их низкую токсичность и иммуногенность. [41] [42] Они также вдохновили на исследования неклеточных методов лечения различных видов рака и заболеваний. [41] Другие желательные аспекты экзосом включают их общую биосовместимость и стабильность. [42] Исследование Нгуена Као и соавторов изучало использование экзосом для доставки индоцианина зеленого (ИЦЗ), соносенсибилизатора для лечения рака молочной железы. [43] Значительно повышенная генерация активных форм кислорода наблюдалась в клетках рака молочной железы, обработанных экзосомами, конъюгированными с фолиевой кислотой. [43] Это один из примеров использования соносенсибилизатора для лечения определенного вида рака с помощью сонодинамической терапии. Другой пример сонодинамической терапии на основе экзосом был проиллюстрирован Лю и др. В этом исследовании экзосомы были украшены порфириновыми сенсибилизаторами, и эта система использовалась с внешним ультразвуковым устройством для контроля и нацеливания доставки лекарств через SDT. [40] Лю и др. представили неинвазивный метод лечения рака посредством экстракорпоральной активации экзосом с помощью ультразвука. [40]

Благодаря своей способности колебаться при воздействии низкочастотного ультразвука микропузырьки использовались в качестве контрастных агентов для визуализации тканей, в которые проникли микропузырьки. [44] Однако, когда эти микросферы подвергаются воздействию ультразвука более высокого давления, они могут разорваться, что может быть полезно для целей доставки лекарств. [44] С помощью SDT эти микропузырьки могут выборочно лопаться в микросреде опухоли, чтобы снизить системные уровни инкапсулированного препарата и повысить терапевтическую эффективность. При применении SDT увеличение акустического давления приводит к инерционной кавитации или коллапсу микропузырька и локальному высвобождению груза внутри. Инерционная кавитация микропузырьков при воздействии SDT также называется разрушением микропузырьков, опосредованным ультразвуком (UMMD). [45] Оболочка микропузырьков может быть украшена различными компонентами, включая полимеры, липиды или белки, в зависимости от их предполагаемого назначения. [44] Микропузырьки также использовались для локализованного высвобождения прикрепленного груза. Этот груз обычно представляет собой химиотерапевтические препараты, антибиотики или гены. [12] Различные лекарства могут быть напрямую загружены в микропузырьки с помощью таких методов, как конъюгация и наночастицы, загрузка липосом и гены. Сочетание генов и SDT называется сонотрансфекцией. [12] Примеры модификаций внешней оболочки можно увидеть в исследовании Макьюэна и др., которые обнаружили, что липидные микропузырьки показали пониженную стабильность, когда к их оболочкам были добавлены соносенсибилизаторы. [44] Однако присоединение полимера полимолочной-ко-гликолевой кислоты (PLGA) к оболочке привело к повышению стабильности по сравнению с липидными микропузырьками без потери других желаемых свойств, таких как целевая доставка и селективная цитотоксичность. [44] В другом исследовании Макьюэн и др. исследовали способность микропузырьков, переносящих кислород, увеличивать выработку активных форм кислорода, которые являются необходимым компонентом SDT, в гипоксической среде многих солидных опухолей. [46] Эти микропузырьки были стабилизированы липидами, а соносенсибилизатор Rose Bengal был прикреплен к поверхности для лечения рака поджелудочной железы. [46] Их работа показала, что соединение кислородсодержащих микропузырьков, чувствительных к ультразвуку, с соносенсибилизирующими препаратами может обеспечить повышенную активацию препарата в желаемой цели, даже если присутствует гипоксия. Примерами терапевтических средств, которые были загружены в микропузырьки, являются гемцитабин, наночастицы паклитаксела, плазмидная ДНК и липосомы, загруженные 2,2′-азобис[2-(2-имидазолин-2-ил)пропан]дигидрохлоридом. [47] [45] [48] [49]Благодаря направленной природе лигандов, связанных с микропузырьком, он позволяет контролировать и целенаправленно нацеливать желаемую ткань для лечения. Другое исследование, проведенное Несбиттом и др., показало улучшенное уменьшение опухоли, когда гемцитабин был загружен в микропузырь и применен к модели ксенотрансплантата рака поджелудочной железы человека с SDT. [48]
Подобно микропузырькам, нанопузырьки показали свою эффективность в SDT. [50] Однако из-за своего меньшего размера нанопузырьки способны достигать целей, которые не могут достичь микропузырьки. Нанопузырьки могут достигать более глубоких тканей и проходить мимо сосудистой сети. Предыдущие исследования показали, что нанопузырьки более способны достигать опухоли, поскольку они могут проникать в эндотелиальные клетки и мигрировать из сосудистой сети. [51] [50] В одном исследовании Ниттаячарна и др. были разработаны нанопузырьки, загруженные доксорубицином, и они были объединены с сенсибилизаторами порфирина для использования в SDT для лечения клеток рака молочной железы и яичников in vitro. [50] Они обнаружили почти 70% увеличение цитотоксичности при использовании SDT по сравнению с нанопузырьками перфторпропана, заполненными только иридием (III). [50] Кроме того, по сравнению с пустыми нанопузырьками и/или свободным иридием (III), они наблюдали наибольшую генерацию активных форм кислорода в нанопузырьках иридия (III), подвергнутых воздействию ультразвука. [50] Эти результаты показывают, что нанопузырьки, загруженные соносенсибилизатором и подвергнутые воздействию ультразвука, могут быть потенциально эффективным средством лечения рака с использованием SDT. Как и в случае с микропузырьками, нанопузырьки также показали себя многообещающими в качестве везикул, доставляющих кислород, для повышения эффективности SDT. Чтобы смягчить гипоксию целевой ткани, Оуэн и др. использовали модель грызунов с раком поджелудочной железы для доставки стабилизированных фосфолипидом нанопузырьков, наполненных кислородом. [52] Мыши были разделены на группы, одна из которых получала заполненные кислородом нанопузырьки до инъекции соносенсибилизатора, а другая — нет. [52] Наблюдалась статистически значимая разница между уровнями кислорода в опухолях двух групп, что указывает на то, что нанопузырьки могут быть эффективным дополнением к SDT для лечения рака в гипоксической среде. [52]
Сонодинамическую терапию можно сочетать с другими терапевтическими методами для повышения эффективности лечения различных видов рака и заболеваний. СДТ можно сочетать с фотодинамической терапией, химиотерапией, облучением, МРТ и иммунотерапией. ФДТ часто использовалась в сочетании с СДТ, поскольку соносенсибилизаторы также являются светочувствительными. [1] Во время первоначальной разработки СДТ Умемура и др. определили, что гематопорфирины способны инициировать гибель клеток аналогично ФДТ. [21] Это связано с тем, что СДТ способна инициировать сонолюминесценцию. Однако преимущество СДТ перед ФДТ заключается в том, что она может проникать глубоко и точно в целевую ткань. В исследовании Луи и др. было показано, что использование комбинации этих двух методов доставки приводит к повышенной цитотоксичности с синопорфирином в модели метастатического ксенотрансплантата. [53] В другом примере сочетания СДТ с ФДТ Бора и др. исследовали преимущество 2-(1-гексилоксиэтил)-2-девинилпирофеофорбида-а (HHPH), препарата для фотодинамической терапии, в качестве соносенсибилизатора и фотосенсибилизатора для лечения глиобластомы. [54] Сочетание этих методов лечения показало повышенную реакцию на гибель клеток/опухоли, возможно, вызванную синергетическими эффектами. [54]
Целью исследования Браунинга и др. было изучение потенциального повышения эффективности химиолучевой терапии путем ее комбинирования с сонодинамической терапией у пациентов с раком поджелудочной железы. В одной модели выживаемость увеличилась при комбинировании по сравнению с химиолучевой терапией в отдельности. Различия в результатах для двух разных моделей можно объяснить различиями в организации опухоли. [6] Опухоли, которые показали наибольшее уменьшение размера, были менее васкуляризированы, что, возможно, делало их более уязвимыми для SDT. [6] В другом исследовании Хуанга и др. использовались элементы мезопористых наносистем на основе органосиликата для изготовления соносенсибилизатора для использования с SDT под контролем МРТ. [55] Соносенсибилизаторы вызывали повышенную гибель клеток и ингибирование роста опухоли, что указывает на высокую эффективность SDT. [55] Это показывает, как SDT может помочь как в удалении, так и в ингибировании роста опухоли. [ необходима ссылка ]
SDT также сочетали с иммунотерапией. Исследование Лин и др. было направлено на использование каскадной иммуно-сонодинамической терапии для улучшения лечения опухолей с использованием антител. [56] Наносоносенсибилизаторы привели к высокой эффективности загрузки лекарств и специфическому для опухоли адаптивному иммунному ответу. Это служит примером того, как SDT можно сочетать с иммунотерапией с блокадой контрольных точек для повышения эффективности лечения рака. Другое исследование Юэ и др. стремилось объединить иммунотерапию с блокадой контрольных точек с неинвазивной сонодинамической терапией, усиленной наносоносенсибилизаторами. [57] Наряду с ингибированием метастазов в легких эта комбинация способствовала противоопухолевому ответу, который запрещал рост опухоли. Это обеспечивает доказательство концепции объединения SDT с другой терапией для усиления эффектов лечения в краткосрочной и долгосрочной перспективе. [ необходима цитата ]
Лечение многих различных типов рака было исследовано с использованием сонодинамической терапии как in vitro, так и in vivo, включая глиобластому, рак поджелудочной железы, молочной железы, яичников, легких, простаты, печени, желудка и толстой кишки. [54] [6] [20] [50] [52] Исследование Гао и др. показало, что SDT способен ингибировать ангиогенез посредством продукции ROS. Это препятствовало пролиферации, миграции и инвазии эндотелиальных клеток, росту опухоли, интратуморальной васкуляризации и экспрессии фактора роста эндотелия сосудов в опухолевой клетке в моделях ксенотрансплантатов крыс. [58] Хачимин и др. провели большое исследование in vitro, тестируя SDT на семнадцати различных линиях раковых клеток. [20] Включенные типы рака включали рак поджелудочной железы, молочной железы, легких, простаты, печени, желудка и толстой кишки. [20] Наиболее успешным лечением был рак легких с 23,4% жизнеспособностью клеток после терапии. [1] [20] Ку и др. стремились разработать платформу наносенсибилизатора «все в одном», запускаемую SDT, которая объединяет различные диагностические и терапевтические эффекты для лечения глиобластомы. [59] Апоптоз был успешно вызван, а митофагия была подавлена в клетках глиомы. Это пример того, как SDT может использоваться с другой платформой для лечения глиобластомы. Бора и др., как упоминалось выше, также исследовали способность SDT (и PDT) лечить глиобластому и обнаружили, что SDT (в сочетании с PDT) способна увеличивать количество убитых опухолевых клеток. [54] Макьюэн и др. и Оуэн и др. продемонстрировали использование микро/нанопузырьков для повышения концентрации кислорода вблизи гипоксических опухолей поджелудочной железы, тем самым увеличивая эффективность SDT. [46] [52]

12% женщин в США будут диагностированы с раком груди . [60] Метастазы и рецидивы являются большой проблемой для глубоко расположенных солидных опухолей. [39] В настоящее время SDT изучается как метод лечения рака груди, позволяющий избежать побочных эффектов, связанных с текущими терапевтическими методами. [61] Был показан успех в использовании SDT в клинических испытаниях на животных и людях в уменьшении размера опухоли посредством митохондриального нацеливания для инициирования апоптоза опухолевых клеток, аутофагии и регуляции иммунного ответа. [62] [39] [ 63] [64] [24] [53] [60] [65] [61] Однако все еще существуют осложнения при надлежащей терапевтической эффективности при использовании в одиночку.

Злокачественная глиома — чрезвычайно сложная для лечения опухоль мозга, которая является основной причиной смерти во всем мире и половиной смертей, связанных с раком. [14] Осложнения, связанные с лечением глиомы, включают гематоэнцефалический барьер (ГЭБ). [14] Этот защитный механизм для мозга также создает проблемы для доставки лекарств через плотные соединения между эндотелиальными клетками, позволяя проникать только небольшим жирорастворимым препаратам (<400 Да). [14] Текущие методы доставки — это хирургия и химиотерапия. SDT был реализован как метод открытия ГЭБ и показал успех в открытии плотных соединений для доставки. Примерами соносенсибилизаторов, показавших успешное лечение глиомы, являются монометиловый эфир гематопорфирина (HMME), порфимер натрия (Photofrin), дисульфо-ди-фталимидометилфталолцианинцинк (ZnPcS2P2), Photolon, 5-аминолевулиновая кислота (5-ALA) и бенгальский розовый (RB). [14] Было показано, что они вызывают такие эффекты, как открытие ГЭБ, улучшение проницаемости сосудов и апоптоз клеток глиомы. [ необходима ссылка ]

Рак предстательной железы является второй причиной рака и наиболее распространенной злокачественной опухолью, связанной со смертельным исходом у мужчин во всем мире. [66] Текущие методы лечения включают инвазивную резекционную терапию, лучевую терапию и простатэктомию, которые могут вызывать такие осложнения, как недержание мочи, импотенция и повреждение окружающих органов и тканей. [67] [17] Текущие исследования показали успешность использования SDT в качестве самостоятельного лечения. [68] SDT использует митохондриальный апоптоз для снижения жизнеспособности клеток. SDT для лечения рака предстательной железы также использовался вместе с химиотерапевтическими средствами, такими как микропузырьки доцетаксела. [17] [67] [68] Было показано, что это усиливает эффекты доцетаксела за счет снижения перфузии опухоли и усиления некроза и апоптоза. [68] Группа SDT и доцетаксела показала снижение роста опухоли. [68] В целом, использование SDT показало многообещающие результаты в лечении рака предстательной железы. [ необходима цитата ]
Сонодинамическая терапия может использоваться для лечения не только рака. Атеросклероз , который является хроническим артериальным заболеванием, является еще одной целью, которая была отмечена в литературе. [3] [5] Это заболевание возникает, когда жировые бляшки скапливаются на внутренней поверхности артерии и может быть вызвано нарушениями липидного обмена. [3] Более конкретно, атеросклероз вызван увеличением проницаемости эндотелия, что приводит к окислению и осаждению частиц липопротеинов низкой плотности. [3] Эти липопротеины вызывают увеличение макрофагов и приводят к усиленному образованию бляшек. В результате высокий приток макрофагов является целью лечения АС с целью замедления образования бляшек. [3] Наряду с взаимосвязью между образованием бляшек и макрофагами, дифференциация моноцитов в макрофаги усугубляет вышеупомянутый процесс, а также вызывает воспаление. [3]
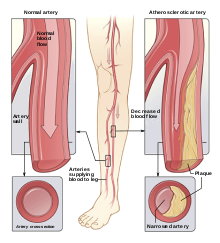
Исследование Ван и др. было направлено на понимание основных механизмов, касающихся потенциального эффекта нелетальной SDT на атеросклеротические бляшки. Было установлено, что нелетальная SDT предотвращает развитие бляшек. [5] Исследование, проведенное Цзяном и др., показало успех в SDT за счет снижения воспалительных факторов макрофагов, таких как TNF-альфа, IL-12 и IL-1B. Они также показали, что SDT может подавлять воспаление бляшек у пациентов с заболеванием периферических артерий и продолжать способствовать положительным результатам в течение более шести месяцев. [4] Популярными соносенсибилизаторами для лечения АС являются протопорфирин IX (PpIX) и 5-аминолевулиновая кислота (5-ALA). [69] [3] PpIX часто используется в PDT и образуется через 5-ALA, не активируемый ультразвуком компонент, за счет увеличения концентрации PpIX внутри клетки. Исследование Ченга и др. определили, что апоптоз макрофагов THP-1 индуцируется увеличением концентрации PpiX, что приводит к образованию большого количества ROS. [70] [13] [3] Использование SDT для лечения AS также продемонстрировало успех в содействии репопуляции сосудистых гладкомышечных клеток (VMSC) путем индукции дальнейшей экспрессии и аутофагии для предотвращения эволюции VMSC в удерживающие бляшки макрофаги. Исследование, проведенное Dan et al., показало увеличение фосфорилирования гладких мышц a-актина, гладких мышц 22a, p38 митоген-активируемой протеинкиназы. [71] [3] В то время как исследование Geng et al. показало улучшение аутофагии VMSC. Каждый из этих факторов способствовал улучшению дифференциации и развития VMSC. [3]
Эксперименты in vitro дают большое понимание и знания для характеристики потенциала поведения соносенсибилизатора in vivo. Кроме того, SDT продемонстрировал успех благодаря своей низкой интенсивности, позволяющей увеличить проницаемость плазматической мембраны без гибели клеток. [1] Соносенсибилизаторы также использовались in vitro в приложениях с различными клеточными линиями и для дальнейшего понимания механизма действия клеточной смерти. В настоящее время известно, что PDT и SDT имеют схожие механизмы генерации свободных радикалов для индукции апоптоза и некроза. [1] Однако каждая клеточная линия уникальна и может вызывать гибель клеток с разной эффективностью. [20] [1] [72] Некоторые примеры работы in vitro включают первоначальные исследования, которые были выполнены Юмитой и соавторами в 1989 году, которые использовали гематопрофирин и SDT для саркомы мыши 180 и асцитной гепатомы крысы (AH), которые показали связь между дозировкой и ультразвуком, а также микропузырьками, вызывающими кавитацию, приводящую к повреждению клеток без использования лекарств. Это исследование также подчеркнуло разницу в эффективности между клеточными линиями через SDT 180, имеющими меньший лизис по сравнению с клетками AH-130. Другое исследование Хачимина и соавторов подчеркнуло эффективность между клеточными линиями, изучив семь различных видов рака с 17 клеточными линиями в общей сложности при использовании DCPH-P-NA(I). [1] [20] Это исследование показало, что линии рака желудка и легких MKN-28 и LU65A соответственно имели самую высокую выживаемость, но линии рака желудка и легких RERFLC-KJ и MKN-45 соответственно имели самую низкую выживаемость. [20] [1] Другое исследование Хонды и соавторов с U937 и K562 показало, что обработка ультразвуком увеличивает внутриклеточные уровни ионов кальция и снижает концентрацию GSH соответственно. [30] Эта повышенная концентрация кальция играет значительную роль в гибели клеток за счет фрагментации ДНК и разрушения митохондриальной мембраны. [1] [30] В то время как пониженная концентрация GSH играет значительную роль в образовании большего количества свободных радикалов. [30] [1] Исследование Умемура и др. показало, что ATX-70 по сравнению с гематопорфирином обладает повышенной цитотоксической активностью. [21] [1] Текущие исследования обычно сосредоточены на использовании моделей ксенотрансплантатов опухолей для определения влияния SDT на целевые клетки и эффективность доставки. [1]
Основываясь на исследовании Umemura et al. и ATX-70, было обнаружено, что через 24 часа после введения соносенсибилизатора эффективность повысилась при применении ультразвука по сравнению с немедленным введением. [21] [1] Также было установлено, что большинство частот ультразвука находятся в диапазоне от 1 до 3 МГц и от 0,5 до 4 Вт/см^2. Более высокие частоты при таких значениях, как 20 Вт/см^2 и 25 Вт/см^2, приводили к большим некротическим поражениям. [73] [1] Это установило связь между формулой соносенсибилизатора и интенсивностью ультразвука для некроза. Другие исследования продолжили вводить новшества в этом направлении, контролируя интервал между лекарственным ультразвуком (DUI) для различных соносенсибилизаторов, чтобы определить оптимальный период времени для применения ультразвука для повышения эффективности. [58] [1] Кроме того, было показано, что SDT может нарушать окружающую сосудистую сеть в опухолях. [1] [58] Это было показано в исследованиях Gao et al. с 5-АЛК на мышах и линиях эндотелиальных клеток пупочной вены человека посредством ингибирования плотности микрососудов и пролиферации клеток, миграции и инвазии. [58] [1]

Одним из многочисленных преимуществ SDT по сравнению с PDT является способность SDT проникать в глубоко расположенные солидные опухоли, что позволяет расширить спектр лечения. [1] Несмотря на этот факт, существуют ограничения SDT, которые необходимо преодолеть или оптимизировать компоненты для расширения эффекта и применения SDT. [31] SDT действительно позволяет точно активировать терапевтическое средство, но ограничена в доставке и накоплении способа доставки для глубокого проникновения в желаемое место опухоли. [74] Это часто обеспечивается через сосуды доставки, такие как наночастицы или липосомы. [1] Однако наномедицина ограничена повышенной проницаемостью и эффектом удержания и испытывает трудности с доставкой в целевом количестве в зависимости от пузырька доставки. [31] [74] Это можно увидеть в наночастицах, которые борются с неспецифической доставкой. Будущие исследования были сосредоточены на разработке высоконацеленных и проникающих наночастиц для улучшенной доставки и фармакокинетики. [75] [31] Из-за сложной природы опухолей и их микросреды их трудно лечить только одной терапией. Чтобы повысить часто низкую выработку активных форм кислорода для решения проблемы гипоксической среды опухоли, SDT можно комбинировать с другими методами лечения, такими как PDT, химиотерапия и иммунотерапия, чтобы улучшить результаты лечения пациентов. [2] [56] [54] [6] SDT сама по себе не дает хорошего эффекта в гипоксической среде. Однако биоредуктивная терапия может использоваться для уменьшения влияния ограничений SDT относительно гипоксии в опухоли, оставляя при этом здоровую/нормальную ткань в покое. [2] Соносенсибилизаторы также требуют постоянного высокого уровня кислорода для создания ROS, который не всегда доступен в гипоксической микросреде опухоли. [31] Однако такие стратегии, как добавление и производство кислорода для обеспечения необходимого кислорода и усиления кавитации, а также истощение глутатиона для предотвращения снижения количества образующихся свободных радикалов, были реализованы наряду с соносенсибилизаторами для обеспечения необходимого кислорода или снижения боевой функции. [76] [74] В дополнение к относительно низкой генерации активных форм кислорода, SDT также может вызывать постоянное разрушение нормальных тканей. Это отсутствие селективности вызвано расхождением ультразвука, что приводит к нагреву и сдвигу, которые воздействуют на нецелевые ткани. [2] Хотя существуют преимущества органических соносенсибилизаторов, такие как высокая воспроизводимость, биосовместимость, производство активных форм кислорода, у них также есть ограничения. [2]Факторы, ограничивающие перенос органических сенсибилизаторов в клинические приложения, включают низкую растворимость в воде, сонотоксичность и нацеливаемость, а также высокую фототоксичность . [2] Другие свойства могут способствовать быстрому выведению препарата, поэтому для транспортировки препарата в желаемое место используются различные нано- и микрочастицы. [2] Кроме того, соносенсибилизаторы в SDT часто требуют повышенной дозировки, а связь между терапевтической дозировкой и токсичностью соносенсибилизаторов не была должным образом охарактеризована наряду с другими переменными, такими как тип ткани и акустическое давление. [31] Неорганические сенсибилизаторы продуцируют активные формы кислорода, но в более низких концентрациях, чем желательно для SDT, что ограничивает их возможность использования в клинических условиях. [2] Другая проблема отражена в работе in vitro и in vivo. Пример этого можно увидеть в исследовании с использованием бенгальского розового, ксантенового красителя. [1] Было обнаружено, что он успешен in vitro, но in vivo показал значительно меньшую эффективность из-за печеночного секрета и выведения. [1] Наконец, в настоящее время не существует стандартизированных компьютерных симуляций для прогнозирования характеристик различных соносензибилизаторов в тканях, которые могли бы предоставить более глубокое понимание того, как могут вести себя соносензибилизаторы. [16]

SDT исследовался чаще всего для борьбы с раком и атеросклерозом, такими как рак молочной железы, рак поджелудочной железы, печени и спинальные саркомы. [7] [3] [8] [9] [13] [12] [11] [10] [16] [15] [14] [77] В настоящее время нет одобренных FDA клинических применений SDT. Однако для PDT, Photofrin является одобренным FDA гематопорфирином (PHOTOFRIN®). Тем не менее, SDT использовался в клиническом испытании в сочетании с PDT для оценки уменьшения размера опухоли у пациентов с раком молочной железы. [1] Однако было трудно определить, был ли SDT PDT или дозировка препарата основным механизмом лечения. [1] Другое исследование случая расширило это, используя SDT в качестве автономного лечения с гормональной терапией белком Gc с использованием 5-ALA или хлорина e6 в качестве соносенсибилизатора. Было показано, что опухолевые маркеры значительно снизились во время лечения. [1] [78]

Эффективность сонодинамической терапии как метода лечения рака подтверждается многочисленными исследованиями in vitro и in vivo. [1] Однако для внедрения в клиническую практику необходимы крупномасштабные клинические испытания. Чтобы смягчить вышеупомянутые ограничения, разрабатываются новые соносенсибилизаторы, а SDT комбинируется с другими методами лечения новыми способами. В частности, необходимо разработать органические соносенсибилизаторы с высокой растворимостью в воде, высокой сонотоксичностью, повышенной способностью воздействовать на опухоли и низкой фототоксичностью, чтобы повысить терапевтическую эффективность SDT и позволить использовать ее для лечения рака. [2] Кроме того, механизмы, посредством которых соносенсибилизаторы вырабатывают ROS при воздействии ультразвука, еще не определены, что снижает способность контролировать его функцию и результаты. В конечном счете, синергические эффекты комбинирования SDT с другими методами лечения позволят каждому из них компенсировать ограничения другого, улучшая их терапевтическую эффективность и увеличивая их способность уничтожать опухоли. [2]