Внутримолекулярная сила (или первичные силы) — это любая сила , которая связывает вместе атомы , составляющие молекулу или соединение, не следует путать с межмолекулярными силами , которые являются силами, присутствующими между молекулами. [1] Тонкое различие в названии происходит от латинских корней английского языка, где inter означает между или среди, а intra означает внутри . [2] Химические связи считаются внутримолекулярными силами, которые часто сильнее, чем межмолекулярные силы, присутствующие между несвязанными атомами или молекулами.
Классическая модель выделяет три основных типа химических связей — ионные, ковалентные и металлические — различающиеся степенью разделения зарядов между участвующими атомами. [3] Характеристики образованной связи можно предсказать по свойствам составляющих ее атомов, а именно электроотрицательности. Они различаются по величине энтальпий связи , меры прочности связи, и, таким образом, по-разному влияют на физические и химические свойства соединений. % ионного характера прямо пропорционален разнице в электроотрицательности связанного атома. [ необходимо разъяснение ]

Ионную связь можно аппроксимировать как полную передачу одного или нескольких валентных электронов атомов, участвующих в образовании связи, в результате чего положительный ион и отрицательный ион связаны вместе электростатическими силами. [4] Электроны в ионной связи, как правило, в основном находятся вокруг одного из двух составляющих атомов из-за большой разницы электроотрицательности между двумя атомами, как правило, более 1,9 (большая разница в электроотрицательности приводит к более прочной связи); это часто описывается как один атом, отдающий электроны другому. [5] Этот тип связи обычно образуется между металлом и неметаллом , например, натрием и хлором в NaCl . Натрий отдает электрон хлору, образуя положительно заряженный ион натрия и отрицательно заряженный ион хлорида.
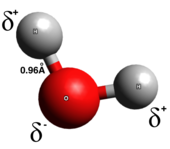
В истинной ковалентной связи электроны равномерно распределены между двумя атомами связи; разделение зарядов незначительно или отсутствует. Ковалентные связи обычно образуются между двумя неметаллами. Существует несколько типов ковалентных связей: в полярных ковалентных связях электроны с большей вероятностью будут находиться вокруг одного из двух атомов, тогда как в неполярных ковалентных связях электроны распределены равномерно. Гомоядерные двухатомные молекулы являются чисто ковалентными. Полярность ковалентной связи определяется электроотрицательностью каждого атома, и, таким образом, полярная ковалентная связь имеет дипольный момент, направленный от частично положительного конца к частично отрицательному концу. [6] Полярные ковалентные связи представляют собой промежуточный тип, в котором электроны не полностью передаются от одного атома к другому и не распределяются равномерно.
Металлические связи обычно образуются внутри чистого металла или металлического сплава . Металлические электроны обычно делокализованы ; результатом является большое количество свободных электронов вокруг положительных ядер , иногда называемых электронным морем.
Связи формируются атомами таким образом, что они способны достигать более низкого энергетического состояния. Свободные атомы будут иметь больше энергии, чем связанный атом. Это происходит потому, что некоторая энергия высвобождается во время образования связи, позволяя всей системе достичь более низкого энергетического состояния. Длина связи или минимальное разделяющее расстояние между двумя атомами, участвующими в образовании связи, определяется их отталкивающими и притягивающими силами вдоль межъядерного направления. [3] По мере того, как два атома становятся все ближе и ближе, положительно заряженные ядра отталкиваются, создавая силу, которая пытается раздвинуть атомы. По мере того, как два атома раздвигаются дальше, силы притяжения работают, чтобы снова стянуть их вместе. Таким образом достигается равновесная длина связи, которая является хорошей мерой стабильности связи.

Внутримолекулярные силы чрезвычайно важны в области биохимии, где они вступают в игру на самых базовых уровнях биологических структур. Внутримолекулярные силы, такие как дисульфидные связи, придают белкам и ДНК их структуру. Белки получают свою структуру из внутримолекулярных сил, которые формируют их и удерживают вместе. Основным источником структуры в этих молекулах является взаимодействие между аминокислотными остатками, которые образуют основу белков. [7] Взаимодействия между остатками тех же белков формируют вторичную структуру белка, позволяя формировать бета-слои и альфа-спирали , которые являются важными структурами для белков и, в случае альфа-спиралей, для ДНК.