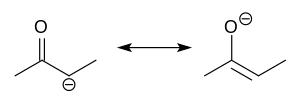
В органической химии еноляты представляют собой органические анионы , полученные в результате депротонирования карбонильных соединений ( RR'C=O ). Редко выделяемые, они широко используются в качестве реагентов при синтезе органических соединений . [1] [2] [3] [4]

Енолят-анионы электронно связаны с аллильными анионами. Анионный заряд делокализован по кислороду и двум углеродным узлам. Таким образом, они имеют характер как алкоксида, так и карбаниона . [5]
Хотя их часто изображают как простые соли, на самом деле они имеют сложную структуру, часто состоящую из агрегатов. [6]

Депротонирование енолизируемых кетонов, ароматических спиртов, альдегидов и сложных эфиров дает еноляты. [8] [9] В случае сильных оснований депротонирование носит количественный характер. Обычно еноляты получают при использовании диизопропиламида лития (LDA). [10]
Часто, как и в обычных конденсациях Кляйзена , реакциях Манниха и альдольных конденсациях , еноляты образуются в низких концентрациях с алкоксидными основаниями. В таких условиях они существуют в небольших концентрациях, но все же вступают в реакции с электрофилами. На поведение енолятов влияет множество факторов, особенно растворитель, добавки (например, диамины) и противокатион (Li + по сравнению с Na + и т. д.). Для несимметричных кетонов существуют методы контроля региохимии депротонирования. [11]

Депротонирование углеродных кислот может протекать как с кинетическим, так и с термодинамическим контролем реакции . Например, в случае фенилацетона депротонирование может привести к образованию двух разных енолятов. Было показано, что LDA депротонирует метильную группу, что является кинетическим ходом депротонирования. Для обеспечения получения кинетического продукта используют небольшой избыток (1,1 экв.) диизопропиламида лития и добавляют кетон к основанию при -78 °С. Поскольку кетон быстро и количественно превращается в енолят, а основание всегда присутствует в избытке, кетон не может действовать как переносчик протонов, катализируя постепенное образование термодинамического продукта. Более слабое основание, такое как алкоксид , который обратимо депротонирует субстрат, дает более термодинамически стабильный бензиленолят.
Еноляты могут улавливаться путем ацилирования и силилирования , которые происходят по кислороду. Эфиры силиленола являются обычными реагентами в органическом синтезе, о чем свидетельствует альдольная реакция Мукаямы : [13]

Помимо использования сильных оснований, еноляты можно получить с использованием кислоты Льюиса и слабого основания («мягкие условия»):

Чтобы произошло депротонирование , стереоэлектронное требование состоит в том, чтобы сигма-связь альфа-СН могла перекрываться с pi*-орбиталью карбонила :
Были проведены обширные исследования образования енолятов. В большинстве случаев можно создать желаемую енолятную геометрию: [14]

Что касается кетонов, то в большинстве условий енолизации образуются еноляты Z. Что касается сложных эфиров , то в большинстве условий енолизации образуются еноляты E. Известно, что добавление HMPA обращает вспять стереоселективность депротонирования.

Стереоселективное образование енолятов было объяснено с помощью модели Ирландии [15] [16] [17] [18] , хотя ее достоверность несколько сомнительна. В большинстве случаев неизвестно, какие промежуточные соединения (если таковые имеются) являются мономерными или олигомерными по своей природе; тем не менее, модель Ирландии остается полезным инструментом для понимания енолятов.

В модели Айрленда предполагается, что депротонирование происходит через шестичленное или циклическое [19] мономерное переходное состояние. Больший из двух заместителей электрофила (в приведенном выше случае метил больше протона) принимает экваториальное расположение в предпочтительном переходном состоянии, что приводит к предпочтению енолятов E. Модель явно терпит неудачу во многих случаях; например, если смесь растворителей заменить с ТГФ на 23% ГМПА-ТГФ (как показано выше), геометрия енолята изменится на противоположную, что несовместимо с этой моделью и ее циклическим переходным состоянием.
Если несимметричный кетон подвергается воздействию основания, он может образовать два региоизомерных енолята (игнорируя геометрию енолята). Например:

Трехзамещенный енолят считается кинетическим енолятом, а тетразамещенный енолят считается термодинамическим енолятом. Альфа-водород, депротонированный с образованием кинетического енолята, менее затруднен и, следовательно, депротонируется быстрее. В общем, тетразамещенные олефины более стабильны, чем тризамещенные олефины, благодаря гиперконъюгативной стабилизации. На соотношение енолятных региоизомеров сильно влияет выбор основания. В приведенном выше примере кинетический контроль может быть установлен с помощью LDA при -78 ° C, что дает селективность кинетического: термодинамического енолята 99:1, тогда как термодинамический контроль может быть установлен с помощью трифенилметиллития при комнатной температуре , что дает селективность 10:90.
В целом, кинетическим енолятам благоприятствуют низкие температуры, условия, которые обеспечивают относительно ионную связь металл-кислород, и быстрое депротонирование с использованием небольшого избытка сильного, стерически затрудненного основания. Большое основание депротонирует только более доступный водород, а низкие температуры и избыток основания помогают избежать уравновешивания с более стабильным альтернативным енолятом после первоначального образования енолята. Термодинамическим енолятам благоприятствует более длительное время установления равновесия при более высоких температурах, условия, которые обеспечивают относительно ковалентную связь металл-кислород, и использование небольшого субстехиометрического количества сильного основания. При использовании недостаточного количества основания для депротонирования всех карбонильных молекул еноляты и карбонилы могут обмениваться протонами друг с другом и уравновешиваться до своего более стабильного изомера. Использование различных металлов и растворителей может обеспечить контроль над количеством ионного характера в связи металл-кислород.
Будучи мощными нуклеофилами, еноляты легко реагируют с различными электрофилами. Эти реакции генерируют новые связи CC и часто новые стереоцентры. На стереоселективность и региоселективность влияют добавки, растворитель, противоионы и т. д. Одним из важных классов электрофилов являются алкилгалогениды, и в этом случае возникает классическая проблема: O-алкилирование против C-алкилирования . Контроль этой избирательности привлек много внимания. Отрицательный заряд в енолятах сосредоточен на кислороде, но этот центр также сильно сольватирован, что приводит к C-алкилированию. [20]
Другими важными электрофилами являются альдегиды/кетоны и акцепторы Михаэля . [21]
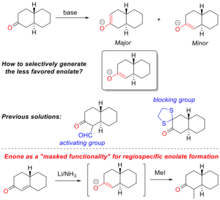

Региоспецифическое образование представляет собой контролируемое образование енолята путем специфического депротонирования одного из α-углеродов исходной молекулы кетона. Это обеспечивает одну из наиболее понятных синтетических стратегий для внесения химической сложности в натуральные продукты и общий синтез . Ярким примером его использования является общий синтез прогестерона, показанный на рисунке «Образование региоспецифического енолята при полном синтезе прогестерона».
Когда кетоны обрабатываются основанием , еноляты могут образовываться путем депротонирования любого α-углерода. Селективность определяется как стерическими , так и электронными эффектами на α-углероды, а также точным используемым основанием (пример см. на рисунке «Маскированная функциональность» для образования региоспецифического енолята). Образование енолята будет термодинамически предпочтительным при наиболее кислом протоне, что зависит от электронной стабилизации образующегося аниона . Однако селективность можно обратить вспять, стерически препятствуя термодинамическому продукту и, следовательно, кинетически благоприятствуя депротонированию в другом α-углеродном центре. Традиционные методы региоселективного образования енолятов используют либо электронные активирующие группы (например, альдегиды ), либо стерические блокирующие группы (например, 1,2-этандитиол- защищенный кетон).
Енон также может служить предшественником региоспецифического образования енолята, здесь енон представляет собой «замаскированную функциональность» енолята. Этот процесс впервые описан Гилбертом Сторком [22] , который наиболее известен своим вкладом в изучение методов селективного образования енолятов в органическом синтезе . Реакция енона с металлическим литием приводит к образованию енолята у α-углерода енона. Енолятный продукт можно либо улавливать, либо алкилировать. Используя «замаскированную функциональность», можно производить еноляты, недоступные традиционными методами.
Подход «замаскированной функциональности» к образованию региоспецифических енолятов широко используется при полном синтезе натуральных продуктов. Например, при полном синтезе стероидного гормона прогестерона [ 23] Сторк и его коллеги использовали «замаскированную функциональность» для стереоспецифического конструирования одного из четвертичных атомов углерода в молекуле.
Азаеноляты (также известные как имин-анионы, енамиды, металлизированные основания Шиффа и металлоенамины) представляют собой азотистые аналоги енолятов. [24] Когда имины обрабатываются сильными основаниями, такими как LDA , образуются высоконуклеофильные азаеноляты.

Основное преимущество использования азаенолятов заключается в том, что они не подвергаются самоконденсации (т.е. альдольной реакции альдегидов ) в основном или нейтральном растворе, а скорее способствуют алкилированию по альфа-углероду. [25] Это происходит главным образом потому, что имины содержат двойные связи углерод-азот в отличие от альдегидов, которые содержат двойные связи кислород-углерод. Поскольку кислород более электроотрицательен, чем азот, он отбирает большую электронную плотность у карбонильного углерода, создавая больший частично положительный заряд на углероде. Следовательно, имея более электрофильный углерод, альдегиды обеспечивают лучшее нуклеофильное присоединение к углероду по двойной связи углерод-кислород.
С другой стороны, имин имеет меньше электроотрицательного азота, что индуцирует более слабый частично положительный заряд на карбонильном углероде. В результате, хотя имины все еще могут реагировать с литийорганическими соединениями, они не реагируют с другими нуклеофилами (включая азаеноляты) с образованием нуклеофильных присоединений . [26]
Вместо этого азаеноляты реагируют аналогично енолятам, образуя SN2- алкилированные продукты. [25] В результате конъюгации неподеленной пары азота β-углерод становится нуклеофильным сайтом, позволяя азаенолятам подвергаться реакциям алкилирования. [27] Таким образом, азаеноляты могут реагировать с многочисленными электрофилами, такими как эпоксиды и алкилгалогениды, с образованием новой углерод-углеродной связи на β-углероде. [24]
Ниже показаны два потенциальных механизма реакции:

Поскольку эпоксид представляет собой трехчленную кольцевую молекулу, он имеет высокую степень деформации кольца . Хотя атомы углерода в кольцевой системе являются тетраэдрическими , предпочтительно 109,5 градусов между каждым атомом, эпоксид деформирует углы кольца до 60 градусов. Чтобы противостоять этому эффекту, нуклеофильные азаеноляты легко реагируют с эпоксидами, уменьшая напряжения их колец.

Помимо реакции с эпоксидами, азаеноляты могут также реагировать с алкилгалогенидами (или аллилгалогенидами, как показано выше) с образованием новой сигма-связи углерод-углерод . Эта реакция является одним из ключевых этапов синтеза феромона мужской агрессии Oulema melanopus. [29] Азаенолят образуется в результате реакции LDA с пивальдегидом, который затем реагирует с алкилгалогенидом с образованием промежуточного соединения Oulema melanopus.
Еноляты аза также могут образовываться с помощью реактивов Гриньяра и реагировать с другими мягкими электрофилами, включая рецепторы Михаэля . [24]