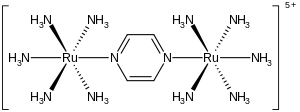
Ион Крейца –Таубе представляет собой металлокомплекс формулы {[ Ru ( NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 5+ . Этот катионный вид тщательно изучался в попытке понять интимные детали переноса электронов во внутренней сфере , то есть того, как электроны перемещаются от одного металлокомплекса к другому. Ион назван в честь Кэрол Крейц , которая первой подготовила комплекс, и ее научного руководителя Генри Таубе , получившего Нобелевскую премию по химии за это и связанные с ним открытия в области переноса электронов. [1] [2]
Комплекс состоит из двух пентаминных рутениевых единиц, связанных с атомами азота мостиковым пиразиновым лигандом, который завершает октаэдрическую координационную сферу каждого металла. Важной особенностью соединения является то, что оба металла имеют кажущуюся дробную степень окисления +2,5. Обычно ионы металлов, как и большинство ионов, имеют целые степени окисления. Например, амминные комплексы рутения обычно имеют +2 или +3. Тот факт, что степени окисления полуцелые, указывает на то, что два центра Ru(NH 3 ) 5 эквивалентны по числу электронов. Кристаллографические и теоретические исследования согласуются с этим описанием, то есть два металлоцентра эквивалентны. [3] [4] Этот ион, характерный для комплекса смешанной валентности , сильно поглощает свет в ближней инфракрасной части электромагнитного спектра . В случае иона Крейца–Таубе максимум поглощения приходится на длину волны 1570 нм . Это поглощение описывается как интервальная полоса переноса заряда .
Первоначально ион был выделен в виде гидратированной тозилатной соли [Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )(O 3 SC 6 H 4 CH 3 ) 5 ·3H 2 O. Его получают в две стадии путем пиразиновый комплекс Ru(III)-Ru(III):. [3]
Ион Крейца-Таубе иллюстрирует преимущества комплексов рутения для изучения окислительно-восстановительных реакций. Ионы Ru(II) и Ru(III) могут взаимно превращаться при слабых окислительно-восстановительных потенциалах . Обе эти степени окисления кинетически инертны. Многие аналоги этого иона были получены с использованием различных мостиковых лигандов.