Конкурентное ингибирование — это прерывание химического пути из-за того, что одно химическое вещество ингибирует эффект другого, конкурируя с ним за связывание или образование связей . Любая метаболическая или химическая система передачи сообщений может потенциально быть затронута этим принципом, но несколько классов конкурентного ингибирования особенно важны в биохимии и медицине , включая конкурентную форму ингибирования ферментов , конкурентную форму антагонизма рецепторов , конкурентную форму антиметаболитной активности и конкурентную форму отравления (которая может включать любой из вышеупомянутых типов).
При конкурентном ингибировании ферментативного катализа связывание ингибитора предотвращает связывание целевой молекулы фермента, также известной как субстрат. [1] Это достигается путем блокирования участка связывания субстрата – активного участка – некоторыми способами. V max указывает максимальную скорость реакции, в то время как K m представляет собой количество субстрата, необходимое для достижения половины V max . K m также играет роль в указании тенденции субстрата связывать фермент. [2] Конкурентное ингибирование можно преодолеть, добавив больше субстрата в реакцию, что увеличивает вероятность связывания фермента и субстрата. В результате конкурентное ингибирование изменяет только K m , оставляя V max прежним. [3] Это можно продемонстрировать с помощью графиков кинетики фермента, таких как график Михаэлиса–Ментена или Лайнуивера–Берка . После связывания ингибитора с ферментом наклон будет изменен, поскольку K m либо увеличивается, либо уменьшается от исходного K m реакции. [4] [5] [6]
Большинство конкурентных ингибиторов функционируют путем обратимого связывания с активным центром фермента. [1] В результате многие источники утверждают, что это определяющая черта конкурентных ингибиторов. [7] Однако это является вводящим в заблуждение упрощением , поскольку существует множество возможных механизмов, с помощью которых фермент может связывать либо ингибитор, либо субстрат, но никогда оба одновременно. [1] Например, аллостерические ингибиторы могут демонстрировать конкурентное, неконкурентное или бесконкурентное ингибирование. [1]
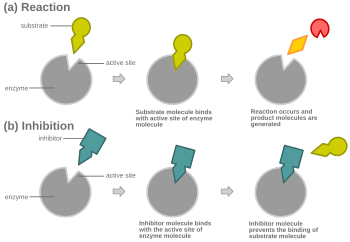
При конкурентном ингибировании ингибитор, который напоминает обычный субстрат, связывается с ферментом, обычно в активном центре , и предотвращает связывание субстрата. [8] В любой момент времени фермент может быть связан с ингибитором, субстратом или ни с тем, ни с другим, но он не может связывать оба одновременно. При конкурентном ингибировании ингибитор и субстрат конкурируют за активный центр. Активный центр — это область на ферменте, с которой может связываться определенный белок или субстрат. Таким образом, активный центр позволит связываться с центром только одному из двух комплексов, либо позволяя реакции произойти, либо приводя к ней. При конкурентном ингибировании ингибитор напоминает субстрат, занимая его место и связываясь с активным центром фермента. Увеличение концентрации субстрата уменьшит «конкуренцию» за то, чтобы субстрат должным образом связался с активным центром и позволил реакции произойти. [3] Когда концентрация субстрата выше, чем концентрация конкурентного ингибитора, более вероятно, что субстрат вступит в контакт с активным центром фермента, чем с активным центром ингибитора.
Конкурентные ингибиторы обычно используются для создания фармацевтических препаратов. [3] Например, метотрексат — это химиотерапевтический препарат, который действует как конкурентный ингибитор. Он структурно похож на кофермент фолат , который связывается с ферментом дигидрофолатредуктазой . [3] Этот фермент является частью синтеза ДНК и РНК, и когда метотрексат связывается с ферментом, он делает его неактивным, так что он не может синтезировать ДНК и РНК. [3] Таким образом, раковые клетки не могут расти и делиться. Другой пример: простагландины вырабатываются в больших количествах в ответ на боль и могут вызывать воспаление. Незаменимые жирные кислоты образуют простагландины; когда это было обнаружено, оказалось, что они на самом деле являются очень хорошими ингибиторами простагландинов. Эти ингибиторы жирных кислот использовались в качестве лекарств для облегчения боли, потому что они могут действовать как субстрат, связываться с ферментом и блокировать простагландины. [9]
Примером конкурентного ингибирования, не связанного с лекарственными средствами, является предотвращение потемнения фруктов и овощей. Например, тирозиназа , фермент в грибах, обычно связывается с субстратом, монофенолами , и образует коричневые о-хиноны. [10] Конкурентные субстраты, такие как 4-замещенные бензальдегиды для грибов, конкурируют с субстратом, снижая количество связывающихся монофенолов. Эти ингибирующие соединения, добавленные к продукту, сохраняют его свежим в течение более длительного времени, уменьшая связывание монофенолов, вызывающих потемнение. [10] Это позволяет повысить качество продукта, а также срок его хранения.
Конкурентное ингибирование может быть обратимым или необратимым. Если это обратимое ингибирование , то эффекты ингибитора можно преодолеть, увеличив концентрацию субстрата. [8] Если оно необратимо, то единственный способ его преодолеть — это произвести больше мишени (и, как правило, разрушить и/или вывести необратимо ингибированную мишень).
Практически в каждом случае конкурентные ингибиторы связываются в том же месте связывания (активном месте), что и субстрат, но связывание в том же месте не является обязательным. Конкурентный ингибитор может связываться с аллостерическим местом свободного фермента и предотвращать связывание субстрата, если только он не связывается с аллостерическим местом, когда субстрат связан. Например, стрихнин действует как аллостерический ингибитор глицинового рецептора в спинном мозге и стволе мозга млекопитающих. Глицин является основным постсинаптическим ингибиторным нейротрансмиттером со специфическим местом рецептора. Стрихнин связывается с альтернативным местом, которое снижает сродство глицинового рецептора к глицину, что приводит к судорогам из-за ослабления ингибирования глицином. [11]
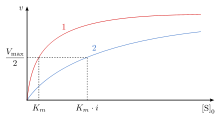
При конкурентном ингибировании максимальная скорость ( ) реакции не изменяется, в то время как кажущееся сродство субстрата к месту связывания уменьшается ( константа диссоциации, по-видимому, увеличивается). Изменение ( константа Михаэлиса–Ментен ) параллельно изменению , по мере увеличения одного другой должен уменьшаться. Когда конкурентный ингибитор связывается с ферментом, увеличивается . Это означает, что сродство связывания с ферментом уменьшается, но его можно преодолеть, увеличив концентрацию субстрата. [12] Любая заданная концентрация конкурентного ингибитора может быть преодолена, увеличив концентрацию субстрата. В этом случае субстрат снизит доступность ингибитора для связывания и, таким образом, превзойдет ингибитор в связывании с ферментом. [12]

После случайного приема внутрь загрязненного опиоидного препарата десметилпродина был обнаружен нейротоксический эффект 1-метил-4-фенил-1,2,3,6-тетрагидропиридина ( MPTP ). MPTP способен проникать через гематоэнцефалический барьер и попадать в кислые лизосомы . [13] MPTP биологически активируется МАО-Б, изоферментом моноаминоксидазы ( МАО), который в основном концентрируется при неврологических расстройствах и заболеваниях. [14] Позже было обнаружено, что MPTP вызывает симптомы, похожие на симптомы болезни Паркинсона . Клетки центральной нервной системы (астроциты) включают МАО-Б, который окисляет MPTP до 1-метил-4-фенилпиридиния (MPP+), который является токсичным. [13] MPP+ в конечном итоге перемещается во внеклеточную жидкость с помощью транспортера дофамина , что в конечном итоге вызывает симптомы болезни Паркинсона. Однако конкурентное ингибирование фермента МАО-Б или транспортера дофамина защищает от окисления MPTP до MPP+. Несколько соединений были протестированы на их способность ингибировать окисление MPTP до MPP+, включая метиленовый синий , 5-нитроиндазол, норхарман , 9-метилнорхарман и менадион . [14] Они продемонстрировали снижение нейротоксичности, производимой MPTP.

Сульфаниламид также действует как конкурентный ингибитор. Например, сульфаниламид конкурентно связывается с ферментом в активном центре дигидроптероатсинтазы (DHPS), имитируя субстрат парааминобензойную кислоту (PABA). [15] Это предотвращает связывание самого субстрата, что останавливает выработку фолиевой кислоты, необходимого питательного вещества. Бактерии должны синтезировать фолиевую кислоту, поскольку у них нет переносчика для нее. Без фолиевой кислоты бактерии не могут расти и делиться. Поэтому из-за конкурентного ингибирования сульфаниламидных препаратов они являются прекрасными антибактериальными средствами. Пример конкурентного ингибирования был продемонстрирован экспериментально для фермента сукцинатдегидрогеназы, который катализирует окисление сукцината до фумарата в цикле Кребса . Малонат является конкурентным ингибитором сукцинатдегидрогеназы. Связывание сукцинатдегидрогеназы с субстратом, сукцинатом, конкурентно ингибируется. Это происходит потому, что химия малоната похожа на сукцинат. Способность малоната ингибировать связывание фермента и субстрата основана на соотношении малоната к сукцинату. Малонат связывается с активным сайтом сукцинатдегидрогеназы, так что сукцинат не может. Таким образом, он ингибирует реакцию. [16]
Модель Михаэлиса–Ментен может быть бесценным инструментом для понимания кинетики ферментов. Согласно этой модели, график скорости реакции (V 0 ), связанный с концентрацией [S] субстрата, может затем использоваться для определения таких значений, как V max , начальная скорость и K m (V max /2 или сродство фермента к комплексу субстрата). [4]
Конкурентное ингибирование увеличивает кажущееся значение константы Михаэлиса-Ментен , , так что начальная скорость реакции, , определяется выражением
где , — константа диссоциации ингибитора, — концентрация ингибитора.
остается прежним, поскольку присутствие ингибитора может быть преодолено более высокими концентрациями субстрата. , концентрация субстрата, необходимая для достижения , увеличивается с присутствием конкурентного ингибитора. Это происходит потому, что концентрация субстрата, необходимая для достижения с ингибитором, больше, чем концентрация субстрата, необходимая для достижения без ингибитора.
В простейшем случае односубстратного фермента, подчиняющегося кинетике Михаэлиса-Ментен, типичная схема
модифицирован, чтобы включить связывание ингибитора со свободным ферментом:
Обратите внимание, что ингибитор не связывается с комплексом ES, а субстрат не связывается с комплексом EI. Обычно предполагается, что такое поведение указывает на связывание обоих соединений в одном и том же месте, но это не является строго необходимым. Как и при выводе уравнения Михаэлиса–Ментен, предположим, что система находится в стационарном состоянии, т. е. концентрация каждого из видов фермента не меняется.
Кроме того, известная общая концентрация фермента составляет , а скорость измеряется в условиях, в которых концентрации субстрата и ингибитора существенно не изменяются, а накопилось незначительное количество продукта.
Поэтому мы можем составить систему уравнений:
где и известны. Начальная скорость определяется как , поэтому нам нужно определить неизвестное через известные и .
Из уравнения ( 3 ) мы можем определить E через ES , переставив его в
Деление на дает
Как и при выводе уравнения Михаэлиса–Ментен, этот член можно заменить макроскопической константой скорости :
Подставляя уравнение ( 5 ) в уравнение ( 4 ), имеем
Переставляя, мы находим, что
На этом этапе мы можем определить константу диссоциации для ингибитора как , что дает
На этом этапе подставим уравнение ( 5 ) и уравнение ( 6 ) в уравнение ( 1 ):
Перестроив уравнение для решения ES, находим
Возвращаясь к нашему выражению для , теперь имеем:
Поскольку скорость максимальна, когда весь фермент связан в виде комплекса фермент-субстрат, . Замена и объединение членов в конечном итоге приводит к общепринятой форме:
Чтобы вычислить концентрацию конкурентного ингибитора , которая дает долю скорости , где :
{{cite book}}: CS1 maint: location missing publisher (link)