В химии нековалентное взаимодействие отличается от ковалентной связи тем, что оно не предполагает совместного использования электронов [1] , а скорее предполагает более рассредоточенные вариации электромагнитных взаимодействий между молекулами или внутри молекулы. Химическая энергия , выделяемая при образовании нековалентных взаимодействий, обычно составляет порядка 1–5 ккал/ моль (1000–5000 калорий на 6,02 × 1023 молекулы). [2] Нековалентные взаимодействия можно разделить на различные категории, такие как электростатические , π-эффекты , силы Ван-дер-Ваальса и гидрофобные эффекты . [3] [2]
Нековалентные взаимодействия [4] имеют решающее значение для поддержания трехмерной структуры больших молекул, таких как белки и нуклеиновые кислоты . Они также участвуют во многих биологических процессах, в которых большие молекулы специфически, но временно связываются друг с другом (см. раздел свойств на странице ДНК ). Эти взаимодействия также сильно влияют на дизайн лекарств , кристалличность и дизайн материалов, особенно для самосборки , и, в целом, на синтез многих органических молекул . [3] [5] [6] [7] [8]
Нековалентные взаимодействия могут возникать между разными частями одной и той же молекулы (например, во время сворачивания белка ) или между разными молекулами и поэтому обсуждаются также как межмолекулярные силы .
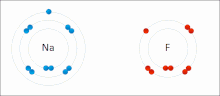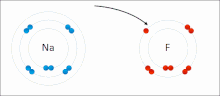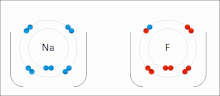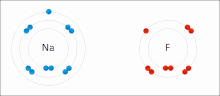
Ионные взаимодействия включают притяжение ионов или молекул с полными постоянными зарядами противоположных знаков. Например, фторид натрия включает притяжение положительного заряда натрия (Na + ) к отрицательному заряду фторида (F - ). [9] Однако это конкретное взаимодействие легко нарушается при добавлении воды или других высокополярных растворителей . В воде ионное спаривание в основном обусловлено энтропией; одиночный солевой мостик обычно имеет величину притяжения около ΔG =5 кДж/моль при промежуточной ионной силе I, при I, близкой к нулю, значение увеличивается примерно до 8 кДж/моль. Значения ΔG обычно аддитивны и в значительной степени не зависят от природы участвующих ионов, за исключением ионов переходных металлов и т. д. [10]
Эти взаимодействия можно также наблюдать в молекулах с локализованным зарядом на определенном атоме . Например, полный отрицательный заряд, связанный с этоксидом , сопряженным основанием этанола , чаще всего сопровождается положительным зарядом соли щелочного металла , такой как катион натрия (Na + ).

Водородная связь (H-связь) представляет собой особый тип взаимодействия, который включает диполь-дипольное притяжение между частично положительным атомом водорода и сильно электроотрицательным, частично отрицательным атомом кислорода, азота, серы или фтора (не связанным ковалентно с указанным водородом). атом). Это не ковалентная связь, а классифицируется как сильное нековалентное взаимодействие. Он отвечает за то, почему вода при комнатной температуре является жидкостью, а не газом (учитывая низкую молекулярную массу воды ). Чаще всего прочность водородных связей лежит в пределах 0–4 ккал/моль, но иногда может достигать 40 ккал/моль [3]. В таких растворителях, как хлороформ или четыреххлористый углерод , наблюдаются, например, при взаимодействии между амидами аддитивные значения около 5 кДж/моль. По мнению Лайнуса Полинга, прочность водородной связи в основном определяется электростатическими зарядами. Измерения тысяч комплексов в хлороформе или четыреххлористом углероде привели к аддитивному увеличению свободной энергии для всех видов донорно-акцепторных комбинаций. [11] [12]

Галогенная связь — это тип нековалентного взаимодействия, которое не включает в себя образование или разрыв реальных связей, а скорее похоже на диполь-дипольное взаимодействие , известное как водородная связь . При галогенной связи атом галогена действует как электрофил , или частица, ищущая электроны, и образует слабое электростатическое взаимодействие с нуклеофилом , или частицей, богатой электронами. Нуклеофильный агент в этих взаимодействиях имеет тенденцию быть сильно электроотрицательным (например, кислород , азот или сера ) или может быть анионным , несущим отрицательный формальный заряд . По сравнению с водородной связью атом галогена заменяет частично положительно заряженный водород в качестве электрофила. [ нужна цитата ]
Галогенную связь не следует путать с галоген-ароматическим взаимодействием, поскольку они связаны, но различаются по определению. Галоген-ароматические взаимодействия включают богатое электронами ароматическое π-облако в качестве нуклеофила; Галогенная связь ограничена одноатомными нуклеофилами. [5]
Силы Ван-дер-Ваальса представляют собой подмножество электростатических взаимодействий, включающих постоянные или индуцированные диполи (или мультиполи). К ним относятся следующие:
Водородная связь и галогенная связь обычно не классифицируются как силы Ван-дер-Ваальса.

Диполь-дипольные взаимодействия — это электростатические взаимодействия между постоянными диполями в молекулах. Эти взаимодействия имеют тенденцию выравнивать молекулы для увеличения притяжения (уменьшения потенциальной энергии ). Обычно диполи связаны с электроотрицательными атомами, включая кислород , азот , серу и фтор .
Например, ацетон , активный ингредиент некоторых средств для снятия лака, имеет чистый диполь, связанный с карбонилом (см. рисунок 2). Поскольку кислород более электроотрицательен, чем углерод, который ковалентно связан с ним, электроны, связанные с этой связью, будут ближе к кислороду, чем к углероду, создавая частичный отрицательный заряд (δ - ) на кислороде и частичный положительный заряд ( δ + ) на углероде. Они не являются полными зарядами, поскольку электроны все еще разделены ковалентной связью между кислородом и углеродом. Если бы электроны больше не были общими, то связь кислород-углерод представляла бы собой электростатическое взаимодействие.
Часто молекулы содержат диполярные группы, но не имеют общего дипольного момента . Это происходит, если внутри молекулы существует симметрия, которая заставляет диполи нейтрализовать друг друга. Это происходит в таких молекулах, как тетрахлорметан . Обратите внимание, что диполь-дипольное взаимодействие между двумя отдельными атомами обычно равно нулю, поскольку атомы редко несут постоянный диполь. См. атомные диполи .
Диполь-индуцированное дипольное взаимодействие ( сила Дебая ) возникает из-за приближения молекулы с постоянным диполем к другой неполярной молекуле без постоянного диполя. Этот подход заставляет электроны неполярной молекулы поляризоваться в сторону диполя или от него (или «индуцировать» диполь) приближающейся молекулы. [13] В частности, диполь может вызывать электростатическое притяжение или отталкивание электронов от неполярной молекулы, в зависимости от ориентации входящего диполя. [13] Атомы с большими атомными радиусами считаются более «поляризуемыми» и поэтому испытывают большее притяжение в результате действия силы Дебая. [ нужна цитата ]
Дисперсионные силы Лондона [14] [15] [16] [17] являются самым слабым типом нековалентного взаимодействия. Однако в органических молекулах множество контактов может привести к большему вкладу, особенно в присутствии гетероатомов. Они также известны как «индуцированные диполь-индуцированные дипольные взаимодействия» и присутствуют между всеми молекулами, даже теми, которые по своей природе не имеют постоянных диполей. Дисперсионные взаимодействия усиливаются с увеличением поляризуемости взаимодействующих групп, но ослабляются растворителями повышенной поляризуемости. [18] Они вызваны временным отталкиванием электронов от электронов соседней молекулы, что приводит к частично положительному диполю на одной молекуле и частично отрицательному диполю на другой молекуле. [6] Гексан является хорошим примером молекулы без полярности или с сильно электроотрицательными атомами, однако при комнатной температуре он остается жидкостью, главным образом, из-за лондонских дисперсионных сил. В этом примере, когда одна молекула гексана приближается к другой, временный, слабый частично отрицательный диполь на входящем гексане может поляризовать электронное облако другой, вызывая частично положительный диполь на этой молекуле гексана. В отсутствие растворителей углеводороды, такие как гексан, образуют кристаллы из-за дисперсионных сил; теплота сублимации кристаллов является мерой дисперсионного взаимодействия. Хотя эти взаимодействия кратковременны и очень слабы, они могут быть причиной того, почему некоторые неполярные молекулы являются жидкостями при комнатной температуре.
π-эффекты можно разбить на множество категорий, включая π-π-взаимодействия , взаимодействия катион-π и анион-π , а также полярные π-взаимодействия. В целом π-эффекты связаны с взаимодействиями молекул с π-системами сопряженных молекул, например бензола . [3]

π–π-взаимодействия связаны с взаимодействием π-орбиталей молекулярной системы. [3] Высокая поляризуемость ароматических колец приводит к дисперсионным взаимодействиям, которые являются основным вкладом в так называемые эффекты стэкинга . Они играют важную роль во взаимодействиях нуклеиновых оснований, например, в ДНК. [19] В качестве простого примера: бензольное кольцо с его полностью сопряженным π-облаком будет взаимодействовать двумя основными способами (и одним второстепенным способом) с соседним бензольным кольцом посредством π – π-взаимодействия (см. рисунок 3). Двумя основными способами формирования стопок бензола являются стыковые с энтальпией ~ 2 ккал/моль и смещенные (или скользящие стопки) с энтальпией ~ 2,3 ккал/моль. [3] Сэндвич-конфигурация не так стабильна во взаимодействии, как две упомянутые ранее, из-за сильного электростатического отталкивания электронов на π-орбиталях. [3]

Взаимодействия катион-пи включают положительный заряд катиона , взаимодействующего с электронами в π-системе молекулы. [3] Это взаимодействие на удивление сильное (в некоторых случаях такое же сильное или даже сильнее, чем Н-связь) [3] и имеет множество потенциальных применений в химических сенсорах. [20] Например, ион натрия может легко располагаться на вершине π-облака молекулы бензола с симметрией C 6 (см. рисунок 4).
Взаимодействия анион-π очень похожи на взаимодействия катион-π, но обратные. В этом случае анион располагается поверх бедной электронами π-системы, обычно образующейся путем размещения электроноакцепторных заместителей на сопряженной молекуле [21]

Полярно-π-взаимодействия включают молекулы с постоянными диполями (например, вода), взаимодействующие с квадрупольным моментом π-системы (например, в бензоле (см. рисунок 5). Хотя эти взаимодействия не такие сильные, как катион-π-взаимодействие, они могут быть довольно сильными (~ 1-2 ккал/моль) и обычно участвуют в сворачивании белков и кристаллизации твердых веществ, содержащих как водородные связи, так и π-системы [3] . Фактически, любая молекула с донором водородной связи (водород связан с. высокоэлектроотрицательный атом) будет иметь благоприятные электростатические взаимодействия с богатой электронами π-системой сопряженной молекулы .
Гидрофобный эффект – это стремление неполярных молекул агрегироваться в водных растворах с целью отделения от воды. [22] Это явление приводит к минимальной площади поверхности неполярных молекул, подвергающейся воздействию полярных молекул воды (обычно сферических капель), и обычно используется в биохимии для изучения сворачивания белков и других различных биологических явлений. [22] Эффект также часто наблюдается при смешивании различных масел (включая растительное масло) и воды. Со временем нефть, находящаяся на поверхности воды, начнет объединяться в большие плоские сферы из более мелких капель, что в конечном итоге приведет к образованию пленки всей нефти, находящейся на поверхности лужи с водой. Однако гидрофобный эффект не считается нековалентным взаимодействием, поскольку он является функцией энтропии, а не специфическим взаимодействием между двумя молекулами, обычно характеризующимся компенсацией энтропии и энтальпии. [23] [24] [25] По существу энтальпийный гидрофобный эффект проявляется, если ограниченное количество молекул воды ограничено внутри полости; замещение таких молекул воды лигандом освобождает молекулы воды, которые затем в объеме воды имеют максимум водородных связей, близких к четырем. [26] [27]
Большинство фармацевтических препаратов представляют собой небольшие молекулы, которые вызывают физиологический ответ путем «связывания» с ферментами или рецепторами , вызывая увеличение или уменьшение способности фермента функционировать. Связывание небольшой молекулы с белком регулируется сочетанием стерических или пространственных факторов, а также различных нековалентных взаимодействий, хотя некоторые лекарства ковалентно модифицируют активный центр (см. необратимые ингибиторы ). Используя «модель замка и ключа» связывания фермента, лекарство (ключ) должно иметь примерно те размеры, которые соответствуют участку связывания фермента (замку). [28] Используя молекулярный каркас соответствующего размера, лекарства также должны взаимодействовать с ферментом нековалентно, чтобы максимизировать константу связывания сродства связывания и уменьшить способность лекарства диссоциировать от места связывания . Это достигается за счет формирования различных нековалентных взаимодействий между небольшой молекулой и аминокислотами в месте связывания, включая: водородные связи , электростатические взаимодействия , пи-стакинг , взаимодействия Ван-дер-Ваальса и диполь-дипольные взаимодействия .
Разработаны нековалентные металлопрепараты. Например, были получены биядерные тройные спиральные соединения, в которых три нити лиганда обертываются вокруг двух металлов, что приводит к образованию примерно цилиндрического тетракатиона. Эти соединения связываются с менее распространенными структурами нуклеиновых кислот, такими как дуплекс ДНК, Y-образные вилочные структуры и четырехсторонние соединения. [29]
Сворачивание белков от первичной (линейной) последовательности аминокислот к трехмерной структуре осуществляется за счет всех типов нековалентных взаимодействий , включая гидрофобные силы и образование внутримолекулярных водородных связей . Трехмерные структуры белков , включая вторичные и третичные структуры , стабилизируются за счет образования водородных связей. Посредством серии небольших конформационных изменений пространственная ориентация модифицируется так, чтобы достичь наиболее энергетически минимизированной ориентации. Складке белков часто способствуют ферменты, известные как молекулярные шапероны . [30] Стерические свойства , напряжение связи и угловое напряжение также играют важную роль в сворачивании белка от его первичной последовательности к третичной структуре.
Отдельные третичные белковые структуры также могут собираться с образованием белковых комплексов, состоящих из множества независимо свернутых субъединиц. В целом это называется четвертичной структурой белка . Четвертичная структура образуется за счет образования относительно сильных нековалентных взаимодействий, таких как водородные связи, между различными субъединицами с образованием функционального полимерного фермента. [31] Некоторые белки также используют нековалентные взаимодействия для связывания кофакторов в активном центре во время катализа, однако кофактор также может быть ковалентно присоединен к ферменту. Кофакторами могут быть как органические, так и неорганические молекулы, которые способствуют каталитическому механизму активного фермента. Сила, с которой кофактор связывается с ферментом, может сильно различаться; нековалентно связанные кофакторы обычно закрепляются за счет водородных связей или электростатических взаимодействий .
Нековалентные взаимодействия оказывают существенное влияние на температуру кипения жидкости. Точка кипения определяется как температура, при которой давление пара жидкости равно давлению, окружающему жидкость. Проще говоря, это температура, при которой жидкость превращается в газ . Как и следовало ожидать, чем сильнее нековалентные взаимодействия присутствуют в веществе, тем выше его температура кипения. Для примера рассмотрим три соединения близкого химического состава: н-бутоксид натрия (C 4 H 9 ONa), диэтиловый эфир (C 4 H 10 O) и н-бутанол (C 4 H 9 OH).

Преобладающие нековалентные взаимодействия, связанные с каждым видом в растворе, перечислены на рисунке выше. Как обсуждалось ранее, для разрыва ионных взаимодействий требуется значительно больше энергии, чем для разрыва водородных связей , которые, в свою очередь, требуют больше энергии, чем диполь-дипольные взаимодействия . Тенденции, наблюдаемые в их температурах кипения (рисунок 8), показывают в точности ожидаемую корреляцию, поскольку н-бутоксиду натрия требуется значительно больше тепловой энергии (более высокая температура) для кипения, чем н-бутанолу, который кипит при гораздо более высокой температуре, чем диэтиловый эфир. Тепловая энергия, необходимая для перехода соединения из жидкого состояния в газообразное, связана с энергией, необходимой для разрушения межмолекулярных сил, которые испытывает каждая молекула в жидком состоянии.