Нестехиометрические соединения — это химические соединения , почти всегда твердые неорганические соединения , имеющие элементный состав, пропорции которого не могут быть представлены отношением малых натуральных чисел (т.е. эмпирической формулой ); чаще всего в таких материалах отсутствует некоторый небольшой процент атомов или слишком много атомов упаковано в идеальную решетку . [ не проверено в тексте ]
В отличие от более ранних определений, современное понимание нестехиометрических соединений рассматривает их как однородные, а не смеси стехиометрических химических соединений. [ не проверено в теле ] Поскольку твердые тела в целом электрически нейтральны, дефект компенсируется изменением заряда других атомов в твердом теле, либо путем изменения их степени окисления , либо путем замены их атомами других элементов с другим зарядом. Многие оксиды и сульфиды металлов имеют нестехиометрические примеры; например, стехиометрический оксид железа(II) , который встречается редко, имеет формулу FeO , тогда как более распространенный материал является нестехиометрическим, с формулой Fe 0,95 O . Тип дефектов равновесия в нестехиометрических соединениях может меняться с сопутствующим изменением объемных свойств материала. [1] Нестехиометрические соединения также проявляют особые электрические или химические свойства из-за дефектов; например, когда атомы отсутствуют, электроны могут перемещаться через твердое тело быстрее. [ не проверено в теле ] Нестехиометрические соединения применяются в керамических и сверхпроводящих материалах, а также в конструкциях электрохимических систем (например, аккумуляторов ). [ необходима ссылка ]
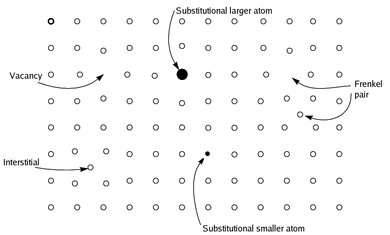
Нестехиометрия широко распространена для оксидов металлов , особенно когда металл не находится в своей наивысшей степени окисления . [2] : 642–644 Например, хотя вюстит ( оксид железа ) имеет идеальную ( стехиометрическую ) формулу FeO , фактическая стехиометрия ближе к Fe 0,95 O. Нестехиометрия отражает легкость окисления Fe 2+ до Fe 3+ , эффективно заменяя небольшую часть Fe 2+ двумя третями их количества Fe 3+ . Таким образом, на каждые три «отсутствующих» иона Fe 2+ кристалл содержит два иона Fe 3+ для уравновешивания заряда. Состав нестехиометрического соединения обычно изменяется непрерывным образом в узком диапазоне. Таким образом, формула для вюстита записывается как Fe 1− x O , где x — небольшое число (0,05 в предыдущем примере), представляющее отклонение от «идеальной» формулы. [3] Нестехиометрия особенно важна в твердых трехмерных полимерах, которые могут допускать ошибки. В некоторой степени энтропия заставляет все твердые тела быть нестехиометрическими. Но для практических целей этот термин описывает материалы, в которых нестехиометрия измерима, обычно не менее 1% от идеального состава. [ необходима цитата ]

Моносульфиды переходных металлов часто нестехиометричны. Наиболее известным, пожалуй, является номинально сульфид железа(II) (минерал пирротин) с составом Fe1−xS ( x = 0 до 0,2 ) . Редкий стехиометрический конечный элемент FeS известен как минерал троилит . Пирротин примечателен тем, что имеет многочисленные политипы , т.е. кристаллические формы , различающиеся по симметрии ( моноклинная или гексагональная ) и составу ( Fe7S8 , Fe9S10 , Fe11S12 и другие). Эти материалы всегда являются железодефицитными из-за наличия дефектов решетки , а именно вакансий железа. Несмотря на эти дефекты , состав обычно выражается как отношение больших чисел, а симметрия кристаллов относительно высока . Это означает, что вакансии железа не хаотично разбросаны по кристаллу, а образуют определенные регулярные конфигурации. Эти вакансии сильно влияют на магнитные свойства пирротина: магнетизм увеличивается с концентрацией вакансий и отсутствует для стехиометрического FeS . [4]
Гидрид палладия — нестехиометрический материал приблизительного состава PdH x (0,02 < x < 0,58). Это твердое вещество проводит водород за счет подвижности атомов водорода внутри твердого тела. [ необходима цитата ]
Иногда бывает трудно определить, является ли материал нестехиометрическим или формула лучше всего представлена большими числами. Оксиды вольфрама иллюстрируют эту ситуацию. Начиная с идеализированного материала триоксида вольфрама , можно создать ряд родственных материалов, которые немного дефицитны по кислороду. Эти виды с дефицитом кислорода можно описать как WO 3− x , но на самом деле они являются стехиометрическими видами с большими элементарными ячейками с формулами W n O 3 n −2 , где n = 20, 24, 25, 40. Таким образом, последний вид можно описать стехиометрической формулой W 40 O 118 , тогда как нестехиометрическое описание WO 2.95 подразумевает более случайное распределение вакансий оксида. [ необходима цитата ]
При высоких температурах (1000 °C) сульфиды титана представляют собой ряд нестехиометрических соединений. [2] : 679
Координационный полимер берлинская лазурь , номинально Fe 7 (CN) 18 и их аналоги, как хорошо известно, образуются в нестехиометрических пропорциях. [5] : 114 Нестехиометрические фазы проявляют полезные свойства в отношении их способности связывать ионы цезия и таллия . [ необходима цитата ]
Многие полезные соединения производятся в результате реакций углеводородов с кислородом , превращения, которое катализируется оксидами металлов. Процесс происходит посредством переноса кислорода «решетки» на углеводородный субстрат, шаг, который временно создает вакансию (или дефект). На следующем шаге недостающий кислород восполняется O 2 . Такие катализаторы полагаются на способность оксида металла образовывать фазы, которые не являются стехиометрическими. [6] Аналогичная последовательность событий описывает другие виды реакций переноса атомов, включая гидрирование и гидродесульфуризацию, катализируемые твердыми катализаторами. Эти соображения также подчеркивают тот факт, что стехиометрия определяется внутренней частью кристаллов: поверхности кристаллов часто не следуют стехиометрии объема. Сложные структуры на поверхностях описываются термином «реконструкция поверхности».
Миграция атомов в твердом теле сильно зависит от дефектов, связанных с нестехиометрией. Эти дефектные участки обеспечивают пути для миграции атомов и ионов через в противном случае плотный ансамбль атомов, которые образуют кристаллы. Датчики кислорода и твердотельные батареи являются двумя приложениями, которые полагаются на оксидные вакансии. Одним из примеров является датчик на основе CeO 2 в автомобильных выхлопных системах. При низких парциальных давлениях O 2 датчик позволяет вводить больше воздуха для более полного сгорания. [6]
Многие сверхпроводники нестехиометричны. Например, оксид иттрия-бария-меди , возможно, самый известный высокотемпературный сверхпроводник , является нестехиометрическим твердым веществом с формулой Y x Ba 2 Cu 3 O 7− x . Критическая температура сверхпроводника зависит от точного значения x . Стехиометрический вид имеет x = 0, но это значение может достигать 1. [6]
В основном благодаря работам Николая Семеновича Курнакова и его учеников было показано, что оппозиция Бертолле закону Пруста имеет значение для многих твердых соединений. Курнаков разделил нестехиометрические соединения на бертоллиды и дальтониды в зависимости от того, показывают ли их свойства монотонное поведение относительно состава или нет. Термин бертоллид был принят ИЮПАК в 1960 году. [7] Названия происходят от Клода Луи Бертолле и Джона Дальтона , соответственно, которые в 19 веке отстаивали конкурирующие теории состава веществ. Хотя Дальтон «победил» в большинстве случаев, позже было признано, что закон определенных пропорций имеет важные исключения. [8]