Нитрат свинца(II) — неорганическое соединение с химической формулой Pb ( NO3 ) 2 . Обычно встречается в виде бесцветных кристаллов или белого порошка и, в отличие от большинства других солей свинца(II) , растворим в воде .
Известное со времен Средневековья под названием plumbum dulce , производство нитрата свинца(II) из металлического свинца или оксида свинца в азотной кислоте было мелкомасштабным, для непосредственного использования в производстве других соединений свинца . В девятнадцатом веке нитрат свинца(II) начал производиться в коммерческих целях в Европе и Соединенных Штатах. Исторически, основным применением было использование в качестве сырья при производстве пигментов для свинцовых красок , но такие краски были вытеснены менее токсичными красками на основе диоксида титана . Другие промышленные применения включали термическую стабилизацию в нейлоне и полиэфирах , а также в покрытиях фототермографической бумаги. Примерно с 2000 года нитрат свинца(II) начал использоваться при цианировании золота .
Нитрат свинца(II) токсичен и требует осторожного обращения, чтобы избежать вдыхания, проглатывания и контакта с кожей. Из-за его опасной природы ограниченные области применения нитрата свинца(II) находятся под постоянным контролем.
Нитрат свинца был впервые обнаружен в 1597 году алхимиком Андреасом Либавиусом , который назвал это вещество plumbum dulce , что означает «сладкий свинец», из-за его вкуса. [5] Он производится в коммерческих целях путем реакции металлического свинца с концентрированной азотной кислотой , в которой он плохо растворяется. [6] [7] Он производился в качестве сырья для изготовления пигментов, таких как хромовый желтый (хромат свинца (II), PbCrO 4 ) и хромовый оранжевый (основной хромат свинца (II), Pb 2 CrO 5 ) и неаполитанский желтый . Эти пигменты использовались для окрашивания и печати на ситце и других текстильных изделиях. [8] Он использовался в качестве окислителя в черном порохе и вместе с азидом свинца в специальных взрывчатых веществах . [9]
Нитрат свинца получают путем реакции оксида свинца(II) с концентрированной азотной кислотой: [10]
Его также можно получить выпариванием раствора, полученного при взаимодействии металлического свинца с разбавленной азотной кислотой . [11]
Растворы и кристаллы нитрата свинца(II) образуются при переработке свинцово- висмутовых отходов свинцовых заводов. [12]
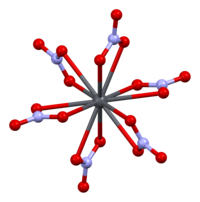

Кристаллическая структура твердого нитрата свинца(II) была определена методом нейтронной дифракции . [13] [14] Соединение кристаллизуется в кубической системе с атомами свинца в гранецентрированной кубической системе. Его пространственная группа Pa3 Z=4 ( обозначение решетки Браве ), с каждой стороной куба длиной 784 пикометра .
Черные точки представляют атомы свинца, белые точки — нитратные группы на 27 пикометров выше плоскости атомов свинца, а синие точки — нитратные группы на том же расстоянии ниже этой плоскости. В этой конфигурации каждый атом свинца связан с двенадцатью атомами кислорода ( длина связи : 281 пм). Все длины связей N–O идентичны и составляют 127 пикометров. [15]
Исследовательский интерес к кристаллической структуре нитрата свинца (II) частично основывался на возможности свободного внутреннего вращения нитратных групп в кристаллической решетке при повышенных температурах, однако это не было реализовано. [14]
Нитрат свинца разлагается при нагревании, это свойство используется в пиротехнике . [9] Он растворяется в воде и разбавленной азотной кислоте.
Основные нитраты образуются при добавлении щелочи к раствору. Pb 2 (OH) 2 (NO 3 ) 2 является преобладающим видом, образующимся при низком pH. При более высоком pH образуется Pb 6 (OH) 5 (NO 3 ). [17] Катион [Pb 6 O(OH) 6 ] 4+ необычен тем, что имеет оксидный ион внутри кластера из 3 тетраэдров PbO 4 с общими гранями . [18] Нет никаких доказательств образования гидроксида Pb(OH) 2 в водном растворе при pH ниже 12.
Растворы нитрата свинца можно использовать для образования координационных комплексов. Свинец(II) является жестким акцептором ; он образует более прочные комплексы с лигандами, отдающими электроны азоту и кислороду . Например, объединение нитрата свинца и пентаэтиленгликоля (ЭО 5 ) в растворе ацетонитрила и метанола с последующим медленным испарением дало соединение [Pb(NO 3 ) 2 (ЭО 5 )]. [19] В кристаллической структуре этого соединения цепь ЭО 5 обернута вокруг иона свинца в экваториальной плоскости , подобной плоскости краун -эфира . Два бидентатных нитратных лиганда находятся в транс-конфигурации . Общее координационное число равно 10, при этом ион свинца находится в молекулярной геометрии двушапочной квадратной антипризмы .
Комплекс, образованный нитратом свинца с бидентатным N-донорным лигандом битиазола, является биядерным. Кристаллическая структура показывает, что нитратная группа образует мостик между двумя атомами свинца. [20] Одним из интересных аспектов этого типа комплексов является наличие физического зазора в координационной сфере ; т. е. лиганды не размещены симметрично вокруг иона металла. Это потенциально связано с неподеленной парой электронов свинца, также обнаруженной в комплексах свинца с имидазольным лигандом. [21]
Нитрат свинца использовался в качестве термостабилизатора в нейлоне и полиэстерах, в качестве покрытия для фототермографической бумаги и в родентицидах . [10]
Нагревание нитрата свинца является удобным способом получения диоксида азота.
В процессе цианирования золота добавление раствора нитрата свинца (II) улучшает процесс выщелачивания . Требуются только ограниченные количества (от 10 до 100 миллиграммов нитрата свинца на килограмм золота). [22] [23]
В органической химии его можно использовать при получении изотиоцианатов из дитиокарбаматов . [24] Сообщалось о его использовании в качестве поглотителя бромида во время замещения S N 1. [25]
Нитрат свинца (II) токсичен, и его прием внутрь может привести к острому отравлению свинцом, как и для всех растворимых соединений свинца. [26] Все неорганические соединения свинца классифицируются Международным агентством по изучению рака (МАИР) как вероятно канцерогенные для человека (категория 2А). [27] Они были связаны с раком почки и глиомой у подопытных животных, а также с раком почки, раком мозга и раком легких у людей, хотя исследования рабочих, подвергавшихся воздействию свинца, часто осложняются сопутствующим воздействием мышьяка . [28] Известно, что свинец заменяет цинк в ряде ферментов , включая дегидратазу δ-аминолевулиновой кислоты (порфобилиногенсинтазу) в пути биосинтеза гема и пиримидин-5′-нуклеотидазу , важную для правильного метаболизма ДНК и, следовательно, может вызывать повреждение плода. [29]
{{cite book}}: CS1 maint: местоположение отсутствует издатель ( ссылка ) CS1 maint: другие ( ссылка )