
В химии резонанс , также называемый мезомерией , представляет собой способ описания связи в определенных молекулах или многоатомных ионах путем объединения нескольких способствующих структур (или форм , [1] также известных как резонансные структуры или канонические структуры ) в резонансный гибрид (или гибридную структуру ) в теории валентных связей . Он имеет особое значение для анализа делокализованных электронов , где связь не может быть выражена одной единственной структурой Льюиса . Резонансный гибрид является точной структурой для молекулы или иона; это среднее значение теоретических (или гипотетических) способствующих структур.
В рамках теории валентных связей резонанс является расширением идеи о том, что связь в химическом виде может быть описана структурой Льюиса. Для многих химических видов одной структуры Льюиса, состоящей из атомов, подчиняющихся правилу октета , возможно, несущих формальные заряды и связанных связями положительного целого порядка, достаточно для описания химической связи и обоснования экспериментально определенных молекулярных свойств, таких как длины связей , углы и дипольный момент . [2] Однако в некоторых случаях можно нарисовать более одной структуры Льюиса, и экспериментальные свойства несовместимы с какой-либо одной структурой. Чтобы рассмотреть этот тип ситуации, несколько вносящих вклад структур рассматриваются вместе как среднее, и говорят, что молекула представлена резонансным гибридом, в котором несколько структур Льюиса используются совместно для описания ее истинной структуры.

Например, в NO 2 – , нитрит- анионе, длины двух связей N–O равны, хотя ни одна структура Льюиса не имеет двух связей N–O с одинаковым формальным порядком связи . Однако его измеренная структура согласуется с описанием как резонансного гибрида двух основных вносящих вклад структур, показанных выше: он имеет две равные связи N–O длиной 125 пм, промежуточные по длине между типичной одинарной связью N–O (145 пм в гидроксиламине , H 2 N–OH) и двойной связью N–O (115 пм в ионе нитрония , [O=N=O] + ). Согласно вносящим вклад структурам, каждая связь N–O является средним значением формальной одинарной и формальной двойной связи, что приводит к истинному порядку связи 1,5. Благодаря этому усреднению описание Льюиса связи в NO 2 – согласуется с экспериментальным фактом, что анион имеет эквивалентные связи N–O.
Резонансный гибрид представляет фактическую молекулу как «среднее» вносящих вклад структур, с длинами связей и частичными зарядами, принимающими промежуточные значения по сравнению с ожидаемыми для отдельных структур Льюиса вкладчиков, если бы они существовали как «реальные» химические сущности. [3] Вносящие вклад структуры отличаются только формальным распределением электронов по атомам, а не фактической физически и химически значимой электронной или спиновой плотностью. В то время как вносящие вклад структуры могут различаться формальными порядками связей и формальными назначениями зарядов , все вносящие вклад структуры должны иметь одинаковое число валентных электронов и одинаковую спиновую кратность . [4]
Поскольку делокализация электронов снижает потенциальную энергию системы, любой вид, представленный резонансным гибридом, более стабилен, чем любая из (гипотетических) способствующих структур. [5] Делокализация электронов стабилизирует молекулу, поскольку электроны более равномерно распределены по молекуле, уменьшая электрон-электронное отталкивание. [6] Разница в потенциальной энергии между фактическим видом и (вычисленной) энергией способствующей структуры с самой низкой потенциальной энергией называется резонансной энергией [7] или энергией делокализации. Величина резонансной энергии зависит от предположений, сделанных относительно гипотетического «нестабилизированного» вида и используемых вычислительных методов, и не представляет собой измеримую физическую величину, хотя сравнения резонансных энергий, вычисленных при аналогичных предположениях и условиях, могут быть химически значимыми.
Молекулы с расширенной π-системой, такие как линейные полиены и полиароматические соединения, хорошо описываются резонансными гибридами, а также делокализованными орбиталями в теории молекулярных орбиталей .
Резонанс следует отличать от изомерии . Изомеры — это молекулы с одинаковой химической формулой, но это разные химические виды с различным расположением атомных ядер в пространстве. С другой стороны, резонансные вкладчики молекулы могут отличаться только способом формального назначения электронов атомам в структурных изображениях молекулы Льюиса. В частности, когда говорят, что молекулярная структура представлена резонансным гибридом, это не означает, что электроны молекулы «резонируют» или смещаются вперед и назад между несколькими наборами положений, каждый из которых представлен структурой Льюиса. Скорее, это означает, что набор способствующих структур представляет собой промежуточную структуру (взвешенное среднее значение вкладчиков) с единой, четко определенной геометрией и распределением электронов. Неправильно рассматривать резонансные гибриды как быстро взаимопревращающиеся изомеры, даже если термин «резонанс» может вызывать такой образ. [8] (Как описано ниже, термин «резонанс» возник как классическая физическая аналогия для квантово-механического явления, поэтому его не следует толковать слишком буквально.) Символически двунаправленная стрелка используется для указания на то, что A и B являются взаимодополняющими формами одного химического вида (в отличие от стрелки равновесия, например, ; подробности об использовании см. ниже).
Нехимическая аналогия иллюстративна: можно описать характеристики реального животного, нарвала , с точки зрения характеристик двух мифических существ: единорога , существа с одним рогом на голове, и левиафана , большого, похожего на кита существа. Нарвал не является существом, которое переходит от единорога к левиафану и обратно, и единорог и левиафан не имеют никакого физического существования вне коллективного человеческого воображения. Тем не менее, описание нарвала с точки зрения этих воображаемых существ дает достаточно хорошее описание его физических характеристик.
Из-за путаницы с физическим значением слова резонанс , поскольку никакие сущности на самом деле физически не «резонируют», было предложено отказаться от термина резонанс в пользу делокализации [9] , а от резонансной энергии в пользу энергии делокализации . Резонансная структура становится способствующей структурой , а резонансный гибрид становится гибридной структурой . Двусторонние стрелки будут заменены запятыми, чтобы проиллюстрировать набор структур, поскольку стрелки любого типа могут указывать на то, что происходит химическое изменение.
На диаграммах структуры, вносящие вклад, обычно разделяются двусторонними стрелками (↔). Стрелку не следует путать с правой и левой стрелками равновесия (⇌). Все структуры вместе могут быть заключены в большие квадратные скобки, чтобы указать, что они изображают одну молекулу или ион, а не разные виды в химическом равновесии .
В качестве альтернативы использованию структур, вносящих вклад в диаграммы, можно использовать гибридную структуру. В гибридной структуре пи-связи , которые участвуют в резонансе, обычно изображаются в виде кривых [10] или пунктирных линий, что указывает на то, что это частичные, а не обычные полные пи-связи. В бензоле и других ароматических кольцах делокализованные пи-электроны иногда изображаются в виде сплошного круга. [11]
Эта концепция впервые появилась в 1899 году в «Гипотезе частичной валентности» Иоганна Тиле для объяснения необычной стабильности бензола, которую нельзя было ожидать от структуры Августа Кекуле , предложенной в 1865 году с чередующимися одинарными и двойными связями. [12] Бензол подвергается реакциям замещения, а не реакциям присоединения, как типично для алкенов . Он предположил, что связь углерод-углерод в бензоле является промежуточной между одинарной и двойной связью.
Предложение резонанса также помогло объяснить число изомеров производных бензола. Например, структура Кекуле предсказывает четыре изомера дибромбензола, включая два орто- изомера с бромированными атомами углерода, соединенными либо одинарной, либо двойной связью. В действительности существует только три изомера дибромбензола, и только один из них является орто, в соответствии с идеей о том, что существует только один тип связи углерод-углерод, промежуточный между одинарной и двойной связью. [13]
Механизм резонанса был введен в квантовую механику Вернером Гейзенбергом в 1926 году при обсуждении квантовых состояний атома гелия. Он сравнил структуру атома гелия с классической системой резонирующих связанных гармонических осцилляторов . [3] [14] В классической системе связь создает две моды, одна из которых имеет более низкую частоту , чем любое из несвязанных колебаний; в квантовой механике эта более низкая частота интерпретируется как более низкая энергия. Лайнус Полинг использовал этот механизм для объяснения частичной валентности молекул в 1928 году и развил его далее в серии статей в 1931-1933 годах. [15] [16] Альтернативный термин мезомерия [17], популярный в немецких и французских публикациях с тем же значением, был введен К. К. Ингольдом в 1938 году, но не прижился в английской литературе. Современная концепция мезомерного эффекта приобрела родственное, но иное значение. Двунаправленная стрелка была введена немецким химиком Фрицем Арндтом, который предпочитал немецкое выражение zwischenstufe или промежуточная стадия .
Теория резонанса доминировала над конкурирующим методом Хюккеля в течение двух десятилетий благодаря тому, что была относительно более простой для понимания для химиков без фундаментальной физической подготовки, даже если они не могли понять концепцию квантовой суперпозиции и путали ее с таутомерией . Сами Полинг и Уиланд характеризовали подход Эриха Хюккеля как «громоздкий» в то время, и его отсутствие навыков общения способствовало этому: когда Роберт Робинсон послал ему дружеский запрос, он высокомерно ответил, что его не интересует органическая химия. [18]
В Советском Союзе теория резонанса, особенно разработанная Полингом, подверглась нападкам в начале 1950-х годов как противоречащая марксистским принципам диалектического материализма , и в июне 1951 года Академия наук СССР под руководством Александра Несмеянова созвала конференцию по химической структуре органических соединений, в которой приняли участие 400 физиков, химиков и философов, где « была раскрыта и разоблачена псевдонаучная сущность теории резонанса» [19] .
Одна способствующая структура может напоминать фактическую молекулу больше, чем другая (в смысле энергии и стабильности). Структуры с низким значением потенциальной энергии более стабильны, чем структуры с высокими значениями, и больше напоминают фактическую структуру. Наиболее стабильные способствующие структуры называются основными способствующими структурами . Энергетически неблагоприятные и, следовательно, менее благоприятные структуры являются второстепенными способствующими структурами . С правилами, перечисленными в приблизительном порядке убывания важности, основными способствующими структурами обычно являются структуры, которые
Максимум восемь валентных электронов является строгим для элементов 2-го периода Be, B, C, N, O и F, как и максимум два для H и He и, по сути, также для Li. [20] Вопрос расширения валентной оболочки элементов третьего периода и более тяжелых главных групп является спорным. Структура Льюиса, в которой центральный атом имеет число валентных электронов больше восьми, традиционно подразумевает участие d-орбиталей в связывании. Однако общее мнение состоит в том, что, хотя они могут вносить незначительный вклад, участие d-орбиталей неважно, и связывание так называемых гипервалентных молекул, по большей части, лучше объясняется формами с разделенным зарядом, которые изображают трехцентровую четырехэлектронную связь . Тем не менее, по традиции, расширенные октетные структуры по-прежнему обычно рисуются для функциональных групп, таких как сульфоксиды , сульфоны и фосфорилиды , например. Такие изображения, рассматриваемые как формализм, который не обязательно отражает истинную электронную структуру, IUPAC предпочитает структурам, содержащим частичные связи, разделение зарядов или дативные связи . [21]
Эквивалентные вкладчики вносят равный вклад в фактическую структуру, в то время как важность неэквивалентных вкладчиков определяется степенью, в которой они соответствуют свойствам, перечисленным выше. Большее количество значимых вкладчиков структур и более объемное пространство, доступное для делокализованных электронов, приводят к стабилизации (снижению энергии) молекулы.
В бензоле две циклогексатриеновые структуры Кекуле , впервые предложенные Кекуле , рассматриваются вместе как способствующие структуры для представления общей структуры. В гибридной структуре справа пунктирный шестиугольник заменяет три двойные связи и представляет шесть электронов в наборе из трех молекулярных орбиталей симметрии π с узловой плоскостью в плоскости молекулы.
В фуране неподеленная пара атома кислорода взаимодействует с π-орбиталями атомов углерода. Изогнутые стрелки изображают перестановку делокализованных π-электронов , что приводит к различным вкладчикам.
Молекула озона представлена двумя составляющими структурами. В действительности два конечных атома кислорода эквивалентны, а гибридная структура изображена справа с зарядом − 1 ⁄ 2 на обоих атомах кислорода и частичными двойными связями с полной и пунктирной линией и порядком связи 1+1 ⁄ 2 . [22] [23]
Для гипервалентных молекул рационализация, описанная выше, может быть применена для генерации структур, способствующих объяснению связей в таких молекулах. Ниже показаны структуры, способствующие связи 3c-4e в дифториде ксенона .
Аллильный катион имеет две структуры с положительным зарядом на концевых атомах углерода. В гибридной структуре их заряд равен + 1 ⁄ 2 . Полный положительный заряд также можно изобразить как делокализованный между тремя атомами углерода.
Молекула диборана описывается структурами, каждая из которых имеет дефицит электронов на разных атомах. Это уменьшает дефицит электронов на каждом атоме и стабилизирует молекулу. Ниже приведены структуры, вносящие вклад в отдельную связь 3c-2e в диборане.
Часто реактивные промежуточные продукты, такие как карбокатионы и свободные радикалы, имеют более делокализованную структуру, чем их исходные реагенты, что приводит к появлению неожиданных продуктов. Классический пример — аллильная перегруппировка . [24] Когда 1 моль HCl добавляется к 1 молю 1,3-бутадиена, в дополнение к обычно ожидаемому продукту 3-хлор-1-бутена, мы также обнаруживаем 1-хлор-2-бутен. Эксперименты с изотопной маркировкой показали, что здесь происходит то, что дополнительная двойная связь смещается из положения 1,2 в положение 2,3 в некоторых продуктах. Это и другие доказательства (такие как ЯМР в суперкислотных растворах) показывают, что промежуточный карбокатион должен иметь высокоделокализованную структуру, отличную от его в основном классической (делокализация существует, но мала) исходной молекулы. Этот катион (аллильный катион) можно представить с помощью резонанса, как показано выше.
Это наблюдение большей делокализации в менее стабильных молекулах является довольно общим. Возбужденные состояния сопряженных диенов стабилизируются больше сопряжением, чем их основные состояния, что приводит к тому, что они становятся органическими красителями. [25]
Хорошо изученный пример делокализации, в которой не участвуют π-электроны ( гиперконъюгация ), можно наблюдать в неклассическом 2-норборниловом катионе [26]. Другим примером является метан ( CH+
5). Их можно рассматривать как содержащие трехцентровые двухэлектронные связи , и они представлены либо структурами, включающими перестройку σ-электронов, либо специальным обозначением Y, которое имеет три ядра в трех своих точках.
Делокализованные электроны важны по нескольким причинам; главная из них заключается в том, что ожидаемая химическая реакция может не произойти, поскольку электроны делокализованы в более стабильную конфигурацию, что приводит к реакции, которая происходит в другом месте. Примером является алкилирование Фриделя-Крафтса [27] бензола с 1-хлор-2-метилпропаном; карбокатион перестраивается в трет - бутильную группу, стабилизированную гиперконъюгацией , особой формой делокализации.
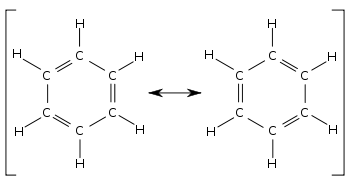
Сравнивая две структуры бензола, все одинарные и двойные связи взаимозаменяемы. Длины связей можно измерить, например, с помощью рентгеновской дифракции . Средняя длина одинарной связи C–C составляет 154 пм ; средняя длина двойной связи C=C составляет 133 пм. В локализованном циклогексатриене связи углерод–углерод должны чередоваться на 154 и 133 пм. Вместо этого все связи углерод–углерод в бензоле оказываются около 139 пм, что является промежуточной длиной связи между одинарной и двойной связью. Этот смешанный характер одинарной и двойной связи (или тройной связи) типичен для всех молекул, в которых связи имеют разный порядок связи в разных структурах, вносящих вклад. Длины связей можно сравнить, используя порядки связей. Например, в циклогексане порядок связи равен 1, тогда как в бензоле он равен 1 + (3 ÷ 6) = 1+1 ⁄ 2. Следовательно, бензол имеет более двойную связь и, следовательно, имеет более короткую длину связи, чем циклогексан.
Энергия резонанса (или делокализации) — это количество энергии, необходимое для преобразования истинной делокализованной структуры в наиболее стабильную способствующую структуру. Эмпирическую резонансную энергию можно оценить, сравнив изменение энтальпии гидрирования реального вещества с оценкой для способствующей структуры.
Полное гидрирование бензола в циклогексан через 1,3-циклогексадиен и циклогексен является экзотермическим ; 1 моль бензола выделяет 208,4 кДж (49,8 ккал).
Гидрирование одного моля двойных связей дает 119,7 кДж (28,6 ккал), как можно вывести из последнего шага, гидрирования циклогексена. В бензоле, однако, требуется 23,4 кДж (5,6 ккал) для гидрирования одного моля двойных связей. Разница, составляющая 143,1 кДж (34,2 ккал), является эмпирической резонансной энергией бензола. Поскольку 1,3-циклогексадиен также имеет небольшую энергию делокализации (7,6 кДж или 1,8 ккал/моль), чистая резонансная энергия, относительно локализованного циклогексатриена, немного выше: 151 кДж или 36 ккал/моль. [28]
Эта измеренная резонансная энергия также представляет собой разницу между энергией гидрирования трех «нерезонансных» двойных связей и измеренной энергией гидрирования:
Независимо от их точных значений, резонансные энергии различных родственных соединений дают представление об их связях. Резонансные энергии для пиррола , тиофена и фурана составляют соответственно 88, 121 и 67 кДж/моль (21, 29 и 16 ккал/моль). [30] Таким образом, эти гетероциклы гораздо менее ароматичны, чем бензол, что проявляется в лабильности этих колец.

Резонанс имеет более глубокое значение в математическом формализме теории валентных связей (VB). Квантовая механика требует, чтобы волновая функция молекулы подчинялась ее наблюдаемой симметрии. Если одна вносящая вклад структура не достигает этого, вызывается резонанс.
Например, в бензоле теория валентных связей начинается с двух структур Кекуле, которые по отдельности не обладают шестикратной симметрией реальной молекулы. Теория конструирует фактическую волновую функцию как линейную суперпозицию волновых функций, представляющих две структуры. Поскольку обе структуры Кекуле имеют одинаковую энергию, они вносят равный вклад в общую структуру — суперпозиция является равновзвешенным средним или линейной комбинацией 1:1 двух в случае бензола. Симметричная комбинация дает основное состояние, в то время как антисимметричная комбинация дает первое возбужденное состояние , как показано.
В общем случае суперпозиция записывается с неопределенными коэффициентами, которые затем вариационно оптимизируются для нахождения минимально возможной энергии для заданного набора базисных волновых функций. Когда включается больше структур, вносящих вклад, молекулярная волновая функция становится более точной, и больше возбужденных состояний можно вывести из различных комбинаций структур, вносящих вклад.

В теории молекулярных орбиталей , основной альтернативе теории валентных связей , молекулярные орбитали (МО) аппроксимируются как суммы всех атомных орбиталей (АО) на всех атомах; имеется столько же МО, сколько и АО. Каждая АО i имеет весовой коэффициент c i , который указывает на вклад АО в конкретную МО. Например, в бензоле модель МО дает нам 6 π МО, которые являются комбинациями 2p z АО на каждом из 6 атомов C. Таким образом, каждая π МО делокализована по всей молекуле бензола, и любой электрон, занимающий МО, будет делокализован по всей молекуле. Эта интерпретация МО вдохновила на создание изображения бензольного кольца в виде шестиугольника с кругом внутри. При описании бензола концепция ВС локализованных σ-связей и концепция МО делокализованных π-орбиталей часто объединяются в элементарных курсах химии.
Вносящие вклад структуры в модели VB особенно полезны для прогнозирования влияния заместителей на π-системы, такие как бензол. Они приводят к моделям вносящих вклад структур для электроноакцепторной группы и электроноотдающей группы на бензоле. Полезность теории МО заключается в том, что количественное указание заряда от π-системы на атоме может быть получено из квадратов весового коэффициента c i на атоме C i . Заряд q i ≈ c2
я. Причина возведения коэффициента в квадрат заключается в том, что если электрон описывается АО, то квадрат АО дает электронную плотность . АО регулируются ( нормализуются ) так, что АО 2 = 1, и q i ≈ ( c i AO i ) 2 ≈ c2
я. В бензоле q i = 1 на каждом атоме C. С электроноакцепторной группой q i < 1 на орто- и параатомах C и q i > 1 для электроноотдающей группы .
Взвешивание структур, вносящих вклад, с точки зрения их вклада в общую структуру можно рассчитать несколькими способами, используя методы "Ab initio" , полученные из теории валентных связей, или же из подходов естественных орбиталей связей (NBO) Вайнхольда NBO5 Архивировано 2008-02-08 на Wayback Machine , или, наконец, из эмпирических расчетов, основанных на методе Хюккеля. Программное обеспечение на основе метода Хюккеля для обучения резонансу доступно на веб-сайте HuLiS.
В случае ионов принято говорить о делокализованном заряде (делокализации заряда). Пример делокализованного заряда в ионах можно найти в карбоксилатной группе, где отрицательный заряд сосредоточен поровну на двух атомах кислорода. Делокализация заряда в анионах является важным фактором, определяющим их реакционную способность (как правило: чем выше степень делокализации, тем ниже реакционная способность) и, в частности, кислотную силу их сопряженных кислот. Как правило, чем лучше делокализован заряд в анионе, тем сильнее его сопряженная кислота . Например, отрицательный заряд в перхлорат- анионе ( ClO−
4) равномерно распределена между симметрично ориентированными атомами кислорода (и часть ее также удерживается центральным атомом хлора). Эта превосходная делокализация заряда в сочетании с большим числом атомов кислорода (четыре) и высокой электроотрицательностью центрального атома хлора приводит к тому, что перхлорная кислота является одной из самых сильных известных кислот со значением ap K a −10. [32]
Степень делокализации заряда в анионе может быть количественно выражена через параметр WAPS (средневзвешенное положительное сигма) [33] , а аналогичный параметр WANS (средневзвешенное отрицательное сигма) [34] [35] используется для катионов.
Значения WAPS и WANS приведены в е / Å 4. Большие значения указывают на более локализованный заряд в соответствующем ионе.
Резонансный гибрид более стабилен, чем любая из участвующих структур.
{{cite web}}: CS1 maint: бот: исходный статус URL неизвестен ( ссылка )См. последний абзац раздела 1.