Олеандомицин — макролидный антибиотик. Синтезируется из штаммов Streptomyces antibioticus . Слабее эритромицина .
Раньше он продавался под торговой маркой Сигмамицин в сочетании с тетрациклином и производился компанией Rosa-Phytopharma во Франции .
Олеандомицин подавляет бактерии, вызывающие инфекции верхних дыхательных путей. Спектр его действия охватывает бактерии родов Staphylococcus и Enterococcus . [ необходима цитата ]
Минимальная ингибирующая концентрация (МИК) олеандомицина составляет 0,3–3 мкг/мл для золотистого стафилококка . [1]
Олеандомицин одобрен в качестве ветеринарного антибиотика в некоторых странах. Он был одобрен в качестве антибиотика для свиней и птицы в Соединенных Штатах. Однако в настоящее время он одобрен в Соединенных Штатах только для использования в производстве. [2] [3]
Олеандомицин был впервые обнаружен как продукт бактерии Streptomyces antibioticus в 1954 году доктором Собиным, Инглишем и Селмером. В 1960 году Хохштейну удалось успешно определить структуру олеандомицина. [5] Этот макролид был открыт примерно в то же время, что и его родственники эритромицин и спирамицин. [6]
Общественный интерес к олеандомицину достиг пика, когда Pfizer представила на рынке комбинированный препарат Sigmamycine в 1956 году. Sigmamycine был комбинированным препаратом олеандомицина и тетрациклина, который поддерживался крупной маркетинговой кампанией. Фактически утверждалось, что смесь 2:1 тетрациклина и олеандомицина имела синергетический эффект на стафилококки. Также утверждалось, что смесь будет эффективна в отношении организмов, которые в основном устойчивы к тетрациклину или олеандомицину по отдельности. Оба эти утверждения были опровергнуты выводами, такими как выводы Лоуренса П. Гаррода, который не смог найти никаких доказательств того, что такие утверждения были должным образом обоснованы. [6] К началу 1970-х годов комбинированные препараты Pfizer были отозваны с рынка. [7] [8] [9]
Олеандомицин является бактериостатическим агентом. Как и эритромицин, олеандомицин связывается с 50-й субъединицей бактериальных рибосом, ингибируя завершение белков, жизненно важных для выживания и репликации. Он препятствует трансляционной активности, а также образованию 50-й субъединицы. [ необходима цитата ]
Однако, в отличие от эритромицина и его эффективных синтетических производных, у него нет 12-гидроксильной группы и 3-метоксигруппы. Это изменение структуры может отрицательно повлиять на его взаимодействие со структурами 50S и объяснить, почему он является менее мощным антибиотиком. [10]
Олеандомицин гораздо менее эффективен, чем эритромицин, в тестах минимальной ингибирующей концентрации бактерий, включающих стафилококки или энтерококки. [1] Однако макролидные антибиотики могут накапливаться в органах или клетках, и этот эффект может продлевать биологическую активность этой категории антибиотиков, даже если их концентрация в плазме ниже той, которая считается способной оказывать терапевтический эффект. [ необходима цитата ]
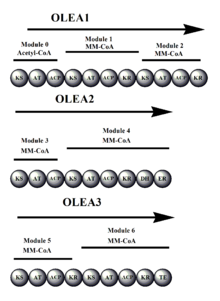
Синтаза олеандомицина (OLES) следует модульной структуре синтазы типа I. Поликетидная цепь связана через тиоэфирные связи с группами SH доменов ACP и KS [ необходима цитата ]
Сходство аминокислотной последовательности между OLES и 6-дезоксиэритронолид B-синтазой (предшественником эритромицина синтазой) показывает только 45% общей идентичности. Обратите внимание, что в отличие от предшественника эритромицина синтазы, в домене загрузки OLES есть KS. [11]
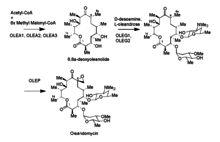
Гены OleG1 и G2 отвечают за гликозилтрансферазы, которые прикрепляют характерные сахара олеандомицина к макролиду. Эти сахара получены из TDP-глюкозы . OLEG1 переносит dTDP-D-дезоамин, а OleG2 переносит D-TDP-L- олеандрозу в макролидное кольцо. Эпоксидирование, которое происходит впоследствии, происходит от фермента, кодируемого OleP, который может быть гомологичен ферменту P450. Предполагается, что метод, с помощью которого OleP эпоксидирует, представляет собой дигидроксилирование с последующим преобразованием гидроксильной группы в фосфатную группу, которая затем уходит через нуклеофильное замыкание кольца другой гидроксильной группой. [11]