
Сигнальный путь вверх по течению запускается связыванием сигнальной молекулы, лиганда , с принимающей молекулой, рецептором . Рецепторы и лиганды существуют во многих различных формах и распознают/связываются только с определенными молекулами. Сигнальный путь вверх по течению внеклеточный трансдуцирует множество внутриклеточных каскадов. [1]
Рецепторы и лиганды являются общими сигнальными молекулами восходящего потока, которые диктуют нисходящие элементы сигнального пути. Множество различных факторов влияют на то, какие лиганды связываются с какими рецепторами и на нисходящий клеточный ответ, который они инициируют.
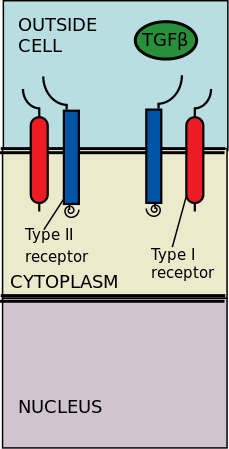
Внеклеточные рецепторы киназы типа II и типа I связываются с лигандами TGF-β. Трансформирующий фактор роста-β (TGF-β) — это суперсемейство цитокинов, которые играют важную роль в регуляции морфогенеза , гомеостаза , пролиферации и дифференцировки клеток. [2] Значимость TGF-β очевидна при заболеваниях человека, которые возникают при нарушении процессов TGF-β, таких как рак, а также скелетные, кишечные и сердечно-сосудистые заболевания. [3] [4] TGF-β является плейотропным и многофункциональным, что означает, что он способен действовать на самые разные типы клеток. [5]
Эффекты трансформирующего фактора роста-β (TGF-β) определяются клеточным контекстом. Существует три типа контекстных факторов, которые определяют форму ответа TGF-β: компоненты передачи сигнала , транскрипционные кофакторы и эпигенетическое состояние клетки. Различные лиганды и рецепторы TGF-β также играют важную роль в составе пути передачи сигнала. [2]
Рецепторы типа II фосфорилируют рецепторы типа I; затем рецепторы типа I получают возможность фосфорилировать цитоплазматические R-Smad, которые затем действуют как регуляторы транскрипции. [6] [2] Сигнализация инициируется связыванием TGF-β с его сериновыми/треониновыми рецепторами. Сериновые/треониновые рецепторы являются рецепторами типа II и типа I на клеточной мембране. Связывание членов TGF-β вызывает сборку гетеротетрамерного комплекса из двух рецепторов типа I и двух рецепторов типа II на плазматической мембране . [6] Отдельные члены семейства TGF-β связываются с определенным набором характерных комбинаций этих рецепторов типа I и типа II. [7] Рецепторы типа I можно разделить на две группы, которые зависят от цитоплазматических R-Smad , которые они связывают и фосфорилируют. Первая группа рецепторов типа I (Alk1/2/3/6) связывает и активирует R-Smads, Smad1/5/8. Вторая группа реакторов типа I (Alk4/5/7) воздействует на R-Smads, Smad2/3. Затем фосфорилированные R-Smads образуют комплексы, и сигналы направляются через два регуляторных канала Smad (R-Smad) (Smad1/5/8 или Smad2/3). [6] [2] После того, как комплексы лиганд-рецептор фосфорилируют цитоплазматические R-Smads, сигнал затем отправляется через Smad 1/5/8 или Smad 2/3. Это приводит к каскаду нисходящих сигналов и нацеливанию клеточных генов. [6] [5]
TGF-β регулирует множественные нисходящие процессы и клеточные функции. Путь сильно варьируется в зависимости от клеточного контекста. Каскад нисходящих сигналов TGF-β включает регуляцию роста клеток, пролиферации клеток , дифференциации клеток и апоптоза . [8]