Пируватдегидрогеназа — это фермент , катализирующий реакцию пирувата и липоамида с образованием ацетилированного дигидролипоамида и углекислого газа . Для превращения требуется кофермент тиаминпирофосфат .
Пируватдегидрогеназа обычно встречается как компонент, называемый E1, пируватдегидрогеназного комплекса (PDC). PDC состоит из других ферментов, называемых E2 и E3. В совокупности E1-E3 преобразуют пируват , NAD + , кофермент A в ацетил-КоА , CO2 и NADH. Преобразование имеет решающее значение, поскольку ацетил-КоА затем может использоваться в цикле лимонной кислоты для осуществления клеточного дыхания . [2] Чтобы отличить этот фермент от PDC, его систематически называют пируватдегидрогеназой (ацетилпереносящей) .

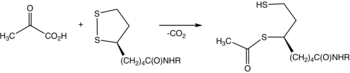
Тиаминпирофосфат (TPP) преобразуется в илид путем депротонирования. Илид атакует кетонную группу пирувата. Полученный аддукт декарбоксилирует . Полученный 1,3-диполь восстановительно ацетилирует липоамид-E2. [2]
В деталях биохимические и структурные данные для E1 выявили механизм активации кофермента TPP путем образования консервативной водородной связи с остатком глутамата (Glu59 в человеческом E1) и путем наложения V-конформации, которая приводит атом N4' аминопиримидина к внутримолекулярной водородной связи с атомом тиазолия C2. Эта уникальная комбинация контактов и конформаций TPP в конечном итоге приводит к образованию реактивного C2-карбаниона. После того, как кофактор TPP декарбоксилирует пируват, ацетильная часть становится гидроксиэтильным производным, ковалентно присоединенным к TPP. [1]
E1 — это мультимерный белок. E1 млекопитающих, включая человеческий E1, являются тетрамерными, состоящими из двух α- и двух β-субъединиц. [1] Некоторые бактериальные E1, включая E1 из Escherichia coli , состоят из двух похожих субъединиц, каждая из которых имеет размер, равный сумме молекулярных масс α- и β-субъединиц. [3]


E1 имеет два каталитических сайта, каждый из которых обеспечивает тиаминпирофосфат ( TPP ) и ион магния в качестве кофакторов. α-субъединица связывает ион магния и фрагмент пирофосфата, в то время как β-субъединица связывает пиримидиновый фрагмент TPP , образуя вместе каталитический сайт на интерфейсе субъединиц. [1]
Активный центр пируватдегидрогеназы (изображение создано из PDB : 1NI4 ) удерживает TPP посредством лигирования металла с ионом магния (фиолетовая сфера) и посредством водородных связей с аминокислотами. Хотя в активном центре можно обнаружить более 20 аминокислот, аминокислоты Tyr 89, Arg 90, Gly 136, Val 138, Asp 167, Gly 168, Ala 169, Asn, 196 и His 263 фактически участвуют в водородных связях для удержания TPP и пирувата (здесь не показано) в активном центре. Аминокислоты показаны в виде проводов, а TPP имеет форму шара и палочки. Активный центр также способствует переносу ацила на TPP на липоамид, ожидающий E2. [1]
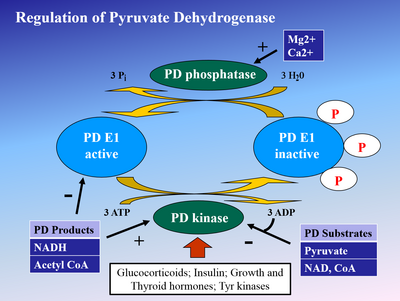
Фосфорилирование E1 пируватдегидрогеназной киназой (PDK) инактивирует E1 и впоследствии весь комплекс. PDK ингибируется дихлоруксусной кислотой и пируватом , что приводит к большему количеству активной, нефосфорилированной PDH. [4] Фосфорилирование обращается пируватдегидрогеназной фосфатазой , которая стимулируется инсулином , PEP и AMP , но конкурентно ингибируется АТФ , НАДН и ацетил-КоА .
Пируватдегидрогеназа является мишенью аутоантигена, известного как антимитохондриальные антитела (AMA), что приводит к прогрессирующему разрушению мелких желчных протоков печени, что приводит к первичному билиарному циррозу . Эти антитела, по-видимому, распознают окисленный белок, который является результатом воспалительных иммунных реакций. Некоторые из этих воспалительных реакций могут быть связаны с чувствительностью к глютену , поскольку более 50% пациентов с острой печеночной недостаточностью в одном исследовании демонстрировали немитохондриальные аутоантитела против тканевой трансглутаминазы . [5] Другие митохондриальные аутоантигены включают оксоглутаратдегидрогеназу и комплекс дегидрогеназы альфа-кетокислот с разветвленной цепью , которые являются антигенами, распознаваемыми антимитохондриальными антителами .
Повышенная активность пируватдегидрогеназы (ПДГ) может вызывать вызванное онкогенами клеточное старение , а также способствовать старению. [6] Снижение активности митохондриальной ПДГ с возрастом было показано в сердце, а также в определенных областях мозга ( полосатом теле и стволе мозга ). [6]
Дефицит пируватдегидрогеназы (ПДГ) является врожденным дегенеративным метаболическим заболеванием, возникающим в результате мутации комплекса пируватдегидрогеназы (ПДК), расположенного на Х-хромосоме. Хотя дефекты были выявлены во всех 3 ферментах комплекса, субъединица E1-α является преимущественно виновником. Нарушение цикла лимонной кислоты из-за дефицита ПДГ лишает организм энергии и приводит к аномальному накоплению лактата. Дефицит ПДГ является распространенной причиной лактатацидоза у новорожденных и часто проявляется тяжелой летаргией, плохим питанием, тахипноэ, а также имели место случаи смерти. [7]
Человеческие белки, обладающие активностью пируватдегидрогеназы, включают:
У бактерий существует форма пируватдегидрогеназы (также называемая пируватоксидазой, EC 1.2.2.2), которая связывает окисление пирувата в ацетат и углекислый газ с восстановлением ферроцитохрома. У E. coli этот фермент кодируется геном pox B , а белок имеет кофактор флавина. [8] Этот фермент увеличивает эффективность роста E. coli в аэробных условиях. [9]
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ){{cite book}}: |journal=проигнорировано ( помощь )