Соматосенсорный вызванный потенциал ( SEP или SSEP ) — это электрическая активность мозга, которая возникает в результате стимуляции прикосновения. Тесты SEP измеряют эту активность и являются полезным неинвазивным средством оценки функционирования соматосенсорной системы . Объединяя записи SEP на разных уровнях соматосенсорных путей, можно оценить передачу афферентного залпа от периферии до коры. Компоненты SEP включают серию положительных и отрицательных отклонений, которые могут быть вызваны практически любыми сенсорными стимулами. Например, SEP могут быть получены в ответ на кратковременное механическое воздействие на кончик пальца или на порывы воздуха. [1] Однако SEP чаще всего вызываются биполярной чрескожной электрической стимуляцией, применяемой к коже по траектории периферических нервов верхней конечности (например, срединного нерва) или нижней конечности (например, заднего большеберцового нерва), а затем регистрируются с кожи головы. [2] В целом, соматосенсорные стимулы вызывают ранние корковые компоненты (N25, P60, N80), генерируемые в контралатеральной первичной соматосенсорной коре (S1), связанные с обработкой атрибутов физического стимула. Примерно через 100 мс после применения стимула активируются дополнительные корковые области, такие как вторичная соматосенсорная кора (S2), а также задняя теменная и фронтальная кора , отмеченные теменным P100 и билатеральным фронтальным N140. Сегодня SEP обычно используются в неврологии для подтверждения и локализации сенсорных аномалий, для выявления скрытых поражений и для мониторинга изменений во время хирургических процедур. [3]
Современная история SEP началась с записей Джорджем Доусоном в 1947 году соматосенсорных корковых реакций у пациентов с миоклонией , неврологическим состоянием, характеризующимся резкими, непроизвольными, рывкообразными сокращениями мышцы или группы мышц. Из-за их относительно большой амплитуды и низкой частоты, совместимых с низкой частотой дискретизации аналого-цифрового преобразования, кортикальные SEP были первыми изучены у нормальных субъектов и пациентов. [2] В 1970-х и начале 1980-х годов были идентифицированы спинальные и подкорковые (дальнепольные) потенциалы. Хотя происхождение и механизмы дальнепольных SEP все еще обсуждаются в литературе, корреляции между аномальными формами волн, местом поражения и клиническими наблюдениями довольно хорошо установлены. Однако самые последние достижения были достигнуты благодаря многоканальным записям вызванных потенциалов в сочетании с моделированием источника и локализацией источника на трехмерных изображениях объема мозга, полученных с помощью магнитно-резонансной томографии (МРТ).
Моделирование источников из распределения поля приводит к моделям активации мозга, которые могут существенно отличаться от наблюдений клинических корреляций между аномальной формой волны и местом поражения. Подход, основанный на клинических корреляциях, поддерживает идею единого генератора для каждого компонента SEP, что подходит для ответов, отражающих последовательные активационные волокна и синаптические реле соматосенсорных путей. Наоборот, моделирование источника предполагает, что вызванное распределение поля в данный момент может быть результатом активности нескольких распределенных источников, которые перекрываются во времени. Эта модель лучше соответствует параллельной активации и контролю обратной связи, которые характеризуют обработку соматосенсорных входов на уровне коры. [2]
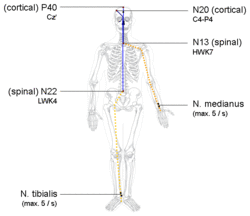
При регистрации SEP обычно стремятся изучить периферические, спинальные, стволовые и ранние корковые SEP во время одного и того же запуска. Электроды, размещенные на коже черепа, улавливают как SEP, генерируемые в коре и таламокортикальных волокнах (которые улавливаются как ответы ближнего поля, расположенные в ограниченных областях), так и позитивы дальнего поля, отражающие вызванную активность, генерируемую в периферических, спинальных и стволовых соматосенсорных волокнах.
Литература полна дискуссий о наиболее подходящем месте для референтного электрода для записи каждого из компонентов. Учитывая распределение поля, оптимальным условием записи в теории является то, при котором референт не подвержен влиянию исследуемой активности. Большинство потенциалов дальнего поля широко распределены по коже головы. Следовательно, они достигают своей максимальной амплитуды, когда референтный электрод не является цефалическим. Нецефалический референт, общий для всех каналов, является достаточным для всех записей ближнего поля. Одним из важных вопросов является то, что уровень электрического физиологического шума (электрокардиограмма, электромиограмма и т. д.) увеличивается с расстоянием между активным и референтным электродами в нецефалических референтных монтажах. Обычные четырехканальные монтажи, предложенные в рекомендациях Международной федерации клинической нейрофизиологии (IFCN), изучают афферентный периферический залп, сегментарные спинальные реакции на уровне шеи и поясничного отдела позвоночника, а также подкорковые дальние поля и ранние корковые SEP, используя скальповые электроды, размещенные в теменных и лобных областях для SEP верхних конечностей и в макушке для SEP нижних конечностей. [2]
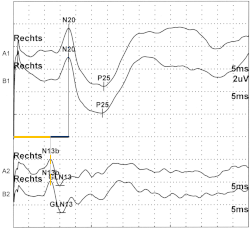
SEP срединного нерва начинается с подачи электрического стимула на этот нерв на запястье. Электрический импульс квадратной волны длительностью 100–300 микросекунд подается с интенсивностью, достаточной для того, чтобы вызвать подергивание большого пальца на 1–2 см. При подаче такого стимула залпы нервного действия перемещаются по чувствительным и двигательным волокнам к плечу, создавая пик при входе. Этот пик формально известен как N9. В ходе проводимости чувствительные волокна затем пересекают шейные корешки и входят в шейный спинной мозг. Затем путь срединного нерва присоединяется к задним столбам, отправляя коллатеральные ветви к синапсу в среднем шейном отделе спинного мозга. Эта активность среднего шейного отдела спинного мозга приводит к пику, известному как N13. N13 лучше всего измерять над пятым шейным позвонком. Дальнейшая проводимость в задних столбах проходит через синапс в цервикомедуллярном соединении и входит в лемнисковый перекрест. На этом уровне генерируется пик P14 на скальпе. По мере того, как проводимость продолжается вверх по медиальной петле к верхнему среднему мозгу и в таламусе, обнаруживается отрицательный пик на скальпе, N18. После синапса в таламусе и прохождения внутренней капсулы , N20 регистрируется над соматосенсорной корой, контралатеральной стимулированному запястью, что соответствует поступлению нервных импульсов в первичную соматосенсорную область. [3]
Стимуляция заднего большеберцового нерва в лодыжке приводит к появлению аналогичной серии последующих пиков. Потенциал N8 может быть обнаружен над задним большеберцовым нервом в колене. Потенциал N22 может быть обнаружен над верхним поясничным отделом позвоночника , что соответствует коллатеральной активности, поскольку сенсорные волокна синаптически связаны в поясничном отделе спинного мозга. Более рострально, шейный потенциал иногда может быть обнаружен над средним или верхним шейным отделом позвоночника . Наконец, скальп-потенциал P37 виден над средней линией скальпа латеральнее срединно-сагиттальной плоскости, но ипсилатерально стимулированной ноге. [3]
Влияние возраста на задержки SEP в основном отражает замедление проводимости в периферических нервах, о чем свидетельствует увеличение компонента N9 после стимуляции срединного нерва. Более короткое время центральной проводимости (CCT, время прохождения восходящего залпа в центральных сегментах соматосенсорных путей) также было зарегистрировано у женщин по сравнению с мужчинами, и также известно, что скорости проводимости зависят от изменений температуры конечностей. Всегда предполагалось, что кортикальные SEP, достигающие пика до 50 мс после стимуляции верхней конечности, не подвергаются значительному влиянию когнитивных процессов. Однако Десмедт и др. (1983) [4] определили потенциал P40 в ответ на целевые стимулы в необычной задаче , предполагая, что процессы, связанные с вниманием, могут влиять на ранние кортикальные SEP. Наконец, некоторые изменения амплитуды, формы волны и латентности теменного N20 были зарегистрированы во время естественного сна у нормальных субъектов. [2]
Срединные и задние большеберцовые SEP используются в различных клинических ситуациях. Они могут обнаруживать, локализовать и количественно определять очаговые прерывания вдоль соматосенсорных путей, которые могут быть вызваны любым количеством очаговых неврологических проблем, включая травму, сдавление, рассеянный склероз , опухоль или другие очаговые поражения. SEP также чувствительны к корковому ослаблению из-за диффузных расстройств центральной нервной системы (ЦНС). Это наблюдается при различных нейродегенеративных расстройствах и метаболических проблемах, таких как дефицит витамина B12 . Когда пациент страдает от сенсорных нарушений и когда клиническая локализация сенсорных нарушений неясна, SEP могут быть полезны для различения того, вызвано ли сенсорное нарушение проблемами ЦНС или проблемами периферической нервной системы. Срединный нерв SEP также полезен для прогнозирования неврологических последствий после остановки сердца : если корковый N20 и последующие компоненты полностью отсутствуют через 24 часа или более после остановки сердца, по сути, все пациенты умирают или имеют вегетативные неврологические последствия. [3]
В последнее десятилетие клиническая полезность SEP вошла в операционную, позволяя проводить интраоперационный мониторинг ЦНС и, таким образом, защищать структуры ЦНС во время операций с высоким риском. Непрерывный мониторинг SEP может предупредить хирурга и ускорить вмешательство до того, как нарушение станет постоянным. [5] Тестирование с помощью SEP срединного нерва используется для идентификации сенсорной и моторной коры во время краниотомии и при мониторинге хирургии на уровне средней или верхней части шеи. Мониторинг SEP заднего большеберцового нерва широко используется для мониторинга спинного мозга во время процедур по лечению сколиоза и других хирургических вмешательств, при которых спинной мозг подвергается риску повреждения. [3] Регистрация пиков, генерируемых внутричерепно в дальнем поле, может облегчить мониторинг, даже если первичные корковые пики нарушены из-за анестетиков. Со временем тестирование и мониторинг SEP в хирургии стали стандартными методами, широко используемыми для снижения риска послеоперационных неврологических проблем у пациента. Непрерывный мониторинг SEP может предупредить хирурга о потенциальном повреждении спинного мозга, что может ускорить вмешательство до того, как нарушение станет постоянным. В целом, SEP могут решать различные конкретные клинические задачи, включая:
Помимо клинических условий, SEP показали свою полезность в различных экспериментальных парадигмах. Шуберт и др. (2006) [6] использовали SEP для исследования дифференциальной обработки осознанно воспринимаемых и невоспринимаемых соматосенсорных стимулов. Авторы использовали парадигму «угасания» для изучения связи между активацией S1 и соматосенсорным осознанием и наблюдали, что ранние SEP (P60, N80), генерируемые в контралатеральном S1, не зависели от восприятия стимула. Напротив, для осознанно воспринимаемых стимулов наблюдалось усиление амплитуды для P100 и N140. Авторы пришли к выводу, что ранняя активация S1 недостаточна для обоснования осознанного восприятия стимула. Сознательная обработка стимула значительно отличается от бессознательной обработки, начиная примерно через 100 мс после предъявления стимула, когда сигнал обрабатывается в теменной и лобной коре, областях мозга, имеющих решающее значение для доступа стимула к осознанному восприятию. В другом исследовании Ивадате и др. (2005) рассмотрели [7] связь между физическими упражнениями и соматосенсорной обработкой с использованием SEP. Исследование сравнивало SEP у спортсменов (футболистов) и неспортсменов, используя два необычных задания после раздельной соматосенсорной стимуляции на срединном нерве и на большеберцовом нерве. В группе спортсменов амплитуды N140 были больше во время задач на верхние и нижние конечности по сравнению с неспортсменами. Авторы пришли к выводу, что пластические изменения в соматосенсорной обработке могут быть вызваны выполнением физических упражнений, требующих внимания и умелых движений.