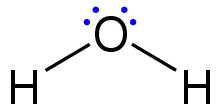
Структуры Льюиса — также называемые формулами точек Льюиса , структурами точек Льюиса , электронными точечными структурами или электронными точечными структурами Льюиса ( СИД ) — это диаграммы, которые показывают связи между атомами молекулы , а также неподеленные пары электронов , которые могут существовать в молекуле. [ 1] [2] [3] Структуру Льюиса можно нарисовать для любой ковалентно связанной молекулы, а также координационных соединений . Структура Льюиса была названа в честь Гилберта Н. Льюиса , который представил ее в своей статье 1916 года «Атом и молекула». [4] Структуры Льюиса расширяют концепцию электронной точечной диаграммы , добавляя линии между атомами для представления общих пар в химической связи.
Структуры Льюиса показывают каждый атом и его положение в структуре молекулы с использованием его химического символа. Линии проводятся между атомами, которые связаны друг с другом (вместо линий можно использовать пары точек). Избыточные электроны, которые образуют неподеленные пары, представлены парами точек и располагаются рядом с атомами.
Хотя элементы основных групп второго периода и далее обычно реагируют, приобретая, теряя или делясь электронами до тех пор, пока они не достигнут электронной конфигурации валентной оболочки с полным октетом (8) электронов, водород (H) может образовывать только связи, которые делят только два электрона.

Для нейтральной молекулы общее число электронов, представленных в структуре Льюиса, равно сумме чисел валентных электронов на каждом отдельном атоме. Невалентные электроны не представлены в структурах Льюиса.
После определения общего числа валентных электронов их помещают в структуру в соответствии со следующими шагами:
Структуры Льюиса для многоатомных ионов можно нарисовать тем же методом. Однако при подсчете электронов отрицательные ионы должны иметь дополнительные электроны, размещенные в их структурах Льюиса; положительные ионы должны иметь меньше электронов, чем незаряженная молекула. Когда записывается структура Льюиса иона, вся структура помещается в скобки, а заряд записывается как верхний индекс в правом верхнем углу, за скобками.
Был предложен более простой метод построения структур Льюиса, устраняющий необходимость подсчета электронов: атомы рисуются с указанием валентных электронов; затем связи образуются путем объединения валентных электронов атомов, участвующих в процессе создания связи, а анионы и катионы образуются путем добавления или удаления электронов к соответствующим атомам или из них. [5]
Хитрость заключается в том, чтобы подсчитать валентные электроны, затем подсчитать количество электронов, необходимых для выполнения правила октета (или для водорода — всего 2 электрона), затем взять разницу этих двух чисел. Ответ — количество электронов, образующих связи. Остальные электроны просто идут на заполнение октетов всех других атомов.
Была предложена еще одна простая и общая процедура записи структур Льюиса и резонансных форм. [6]
Эта система работает почти во всех случаях, однако есть 3 случая, когда она не будет работать [ требуется ссылка ] . Эти исключения указаны в таблице ниже.
В терминах структур Льюиса формальный заряд используется в описании, сравнении и оценке вероятных топологических и резонансных структур [7] путем определения кажущегося электронного заряда каждого атома внутри, на основе его электронной точечной структуры, предполагая исключительную ковалентность или неполярную связь. Он используется при определении возможной электронной реконфигурации при обращении к механизмам реакции и часто приводит к тому же знаку, что и частичный заряд атома, с исключениями. В общем, формальный заряд атома можно рассчитать с помощью следующей формулы, предполагая нестандартные определения для используемой разметки:
где:
Формальный заряд атома вычисляется как разница между числом валентных электронов, которые имел бы нейтральный атом, и числом электронов, которые принадлежат ему в структуре Льюиса. Электроны в ковалентных связях делятся поровну между атомами, участвующими в связи. Сумма формальных зарядов на ионе должна быть равна заряду на ионе, а сумма формальных зарядов на нейтральной молекуле должна быть равна нулю.
Для некоторых молекул и ионов трудно определить, какие неподеленные пары должны быть перемещены для образования двойных или тройных связей, и для одной и той же молекулы или иона могут быть записаны две или более различных резонансных структур. В таких случаях обычно все их записывают с двусторонними стрелками между ними . Иногда это происходит, когда несколько атомов одного типа окружают центральный атом, и это особенно характерно для многоатомных ионов.
Когда возникает такая ситуация, говорят, что структура Льюиса молекулы является резонансной структурой , и молекула существует как резонансный гибрид. Каждая из различных возможностей накладывается на другие, и считается, что молекула имеет структуру Льюиса, эквивалентную некоторой комбинации этих состояний.
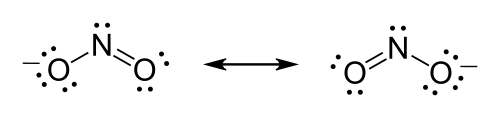
Нитрат-ион ( NO−3), например, должен образовать двойную связь между азотом и одним из атомов кислорода, чтобы удовлетворить правилу октета для азота. Однако, поскольку молекула симметрична, неважно, какой из атомов кислорода образует двойную связь. В этом случае существует три возможные резонансные структуры. Выражение резонанса при рисовании структур Льюиса может быть сделано либо путем рисования каждой из возможных резонансных форм и размещения двунаправленных стрелок между ними, либо путем использования пунктирных линий для представления частичных связей (хотя последнее является хорошим представлением резонансного гибрида, который формально не является структурой Льюиса).
При сравнении резонансных структур для одной и той же молекулы, как правило, те, у которых меньше всего формальных зарядов, вносят больший вклад в общий резонансный гибрид. Когда необходимы формальные заряды, предпочтение отдается резонансным структурам, имеющим отрицательные заряды на более электроотрицательных элементах и положительные заряды на менее электроотрицательных элементах.
Одинарные связи также можно перемещать таким же образом, создавая резонансные структуры для гипервалентных молекул , таких как гексафторид серы , что является правильным описанием согласно квантово-химическим расчетам вместо общепринятой модели расширенного октета.
Резонансную структуру не следует интерпретировать как указание на то, что молекула переключается между формами, а на то, что молекула действует как среднее арифметическое нескольких форм.
Формула нитрит- иона — NO.−2.

Химические структуры могут быть записаны в более компактных формах, особенно при отображении органических молекул . В сжатых структурных формулах многие или даже все ковалентные связи могут быть опущены, с нижними индексами, указывающими количество идентичных групп, присоединенных к определенному атому. Другая сокращенная структурная диаграмма — это скелетная формула (также известная как формула линий связи или диаграмма углеродного скелета). В скелетной формуле атомы углерода обозначены не символом C, а вершинами линий . Атомы водорода, связанные с углеродом, не показаны — их можно вывести, подсчитав количество связей с определенным атомом углерода — предполагается, что каждый углерод имеет всего четыре связи, поэтому любые не показанные связи, по сути, относятся к атомам водорода.
Другие диаграммы могут быть более сложными, чем структуры Льюиса, показывая связи в трехмерном пространстве с использованием различных форм, таких как диаграммы заполнения пространства .
Несмотря на свою простоту и развитие в начале двадцатого века, когда понимание химической связи было еще рудиментарным, структуры Льюиса охватывают многие ключевые особенности электронной структуры ряда молекулярных систем, включая те, которые имеют отношение к химической реакционной способности. Таким образом, они продолжают широко использоваться химиками и преподавателями химии. Это особенно верно в области органической химии , где традиционная модель валентной связи все еще доминирует, и механизмы часто понимаются в терминах обозначений кривых и стрелок , наложенных на скелетные формулы , которые являются сокращенными версиями структур Льюиса. Из-за большего разнообразия схем связей, встречающихся в неорганической и металлоорганической химии , многие из встречающихся молекул требуют использования полностью делокализованных молекулярных орбиталей для адекватного описания их связи, что делает структуры Льюиса сравнительно менее важными (хотя они все еще распространены).
Существуют простые и архетипические молекулярные системы, для которых описание Льюиса, по крайней мере в неизмененной форме, является вводящим в заблуждение или неточным. В частности, наивное рисование структур Льюиса для молекул, которые, как известно экспериментально, содержат неспаренные электроны (например, O 2 , NO и ClO 2 ), приводит к неправильным выводам о порядках связей, длинах связей и/или магнитных свойствах. Простая модель Льюиса также не учитывает явление ароматичности . Например, структуры Льюиса не дают объяснения тому, почему циклический C 6 H 6 (бензол) испытывает особую стабилизацию помимо обычных эффектов делокализации, в то время как C 4 H 4 (циклобутадиен) на самом деле испытывает особую дестабилизацию . [ необходима цитата ] Теория молекулярных орбиталей дает наиболее простое объяснение этих явлений. [ оригинальное исследование? ]