Синтез кетонов Вайнреба или синтез кетонов Вайнреба–Нама — это химическая реакция, используемая в органической химии для создания связей углерод–углерод . Она была открыта в 1981 году Стивеном М. Вайнребом и Стивеном Намом как метод синтеза кетонов . [1] Первоначальная реакция включала два последовательных замещения: преобразование хлорангидрида кислоты с N , O -диметилгидроксиламином для образования амида Вайнреба–Нама и последующую обработку этого вида металлоорганическим реагентом, таким как реактив Гриньяра или литийорганический реагент . Нам и Вайнреб также сообщили о синтезе альдегидов путем восстановления амида избытком алюмогидрида лития (см. восстановление амида ).

Главное преимущество этого метода по сравнению с добавлением металлоорганических реагентов к более типичным ацильным соединениям заключается в том, что он позволяет избежать распространенной проблемы избыточного добавления. Для этих последних реакций два эквивалента входящей группы добавляются с образованием спирта, а не кетона или альдегида. Это происходит даже если эквиваленты нуклеофила строго контролируются.
С тех пор амид Вайнреба-Нама был принят в регулярное использование химиками-органиками как надежный метод синтеза кетонов. Эти функциональные группы присутствуют во многих природных продуктах и могут надежно реагировать с образованием новых связей углерод-углерод или преобразовываться в другие функциональные группы. Этот метод использовался в ряде синтезов, включая макросфелиды A и B, [2] амфидинолид J, [3] и спирофунгины A и B. [4]
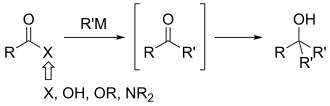
Вайнреб и Нам изначально предложили следующий механизм реакции для объяснения селективности, показанной в реакциях амида Вайнреба–Нама. Их предположение состояло в том, что тетраэдрический промежуточный продукт ( A ниже), образованный в результате нуклеофильного присоединения металлоорганическим реагентом , стабилизируется хелатированием метоксигруппы , как показано. [ 1] Этот промежуточный продукт стабилен только при низких температурах, требуя низкотемпературного гашения .

Это хелатирование контрастирует с механизмом образования продукта сверхприсоединения, где коллапс тетраэдрического промежуточного соединения допускает второе присоединение. Механистическая гипотеза со стороны Вайнреба была немедленно принята академическим сообществом, но только в 2006 году она была подтверждена спектроскопическим и кинетическим анализами. [5]
В дополнение к оригинальной процедуре, показанной выше (которая может иметь проблемы совместимости для чувствительных субстратов), амиды Вайнреба могут быть синтезированы из различных ацильных соединений. Подавляющее большинство этих процедур используют коммерчески доступную соль N,O-диметилгидроксиламин гидрохлорид [MeO(Me)NH•HCl], с которой обычно легче работать, чем со свободным амином. [6]
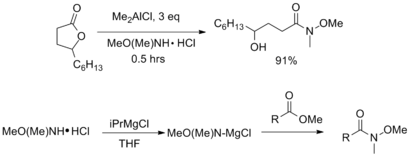
Обработка эфира или лактона с помощью AlMe 3 или AlMe 2 Cl дает соответствующий амид Вайнреба с хорошим выходом. В качестве альтернативы, ненуклеофильные реагенты Гриньяра, такие как изопропиловый хлорид магния, могут быть использованы для активации амина перед добавлением эфира. [7]
Различные пептидные связующие реагенты также могут быть использованы для приготовления амидов Вайнреба-Нама из карбоновых кислот. Различные карбодиимидные , гидроксибензотриазольные и трифенилфосфиновые связующие были описаны специально для этой цели. [6] [7]

Наконец, реакция аминокарбонилирования, описанная Стивеном Бухвальдом, позволяет преобразовывать арилгалогениды непосредственно в ариламиды Вайнреба-Нама. [8]

Стандартные условия для синтеза кетона Вайнреба-Нама, как известно, допускают широкий спектр функциональных групп в других местах молекулы, включая замещение альфа-галогена, N-защищенные аминокислоты , α-β ненасыщенность, силиловые эфиры , различные лактамы и лактоны, сульфонаты , сульфинаты и фосфонатные эфиры. [6] [7] В сочетании с амидом можно использовать широкий спектр нуклеофилов. Чаще всего используются литиаты и реагенты Гриньяра ; сообщалось о примерах, включающих алифатические , винильные , арильные и алкинильные углеродные нуклеофилы . Однако с высокоосновными или стерически затрудненными нуклеофилами элиминирование метоксидной группы для высвобождения формальдегида может происходить как значительная побочная реакция. [9]

Тем не менее, амид Вайнреба-Нама играет видную роль во многих синтезах, выступая в качестве важного партнера по связыванию для различных фрагментов. Ниже показаны ключевые шаги, включающие амиды Вайнреба в синтезе нескольких природных продуктов, включая членов семейства иммунодепрессантов макросфелидов и семейства антибиотиков спирофунгинов. [2] [3] [4]

Реакция амидов Вайнреба-Нама с реагентами Виттига была проведена, чтобы избежать иногда жестких условий, необходимых для добавления гидридных реагентов или металлоорганических соединений. Это дает N-метил-N-метоксиенамин , который преобразуется в соответствующий кетон или альдегид при гидролитической обработке. [10]

Кроме того, был разработан однореакторный обмен магния и галогена с последующим арилированием, демонстрирующий стабильность амида Вайнреба-Нама и обеспечивающий простой в эксплуатации метод синтеза арилкетонов. [11]
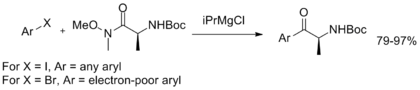
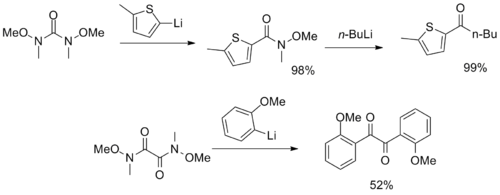
Были синтезированы более необычные реагенты с несколькими функциональными группами амида Вайнреба-Нама, которые служат синтонами CO2 и α-дикетона . [12] [13]
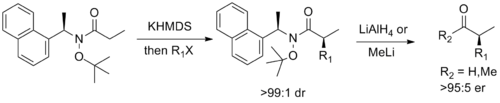
Наконец, Стивен Г. Дэвис из Оксфорда разработал хиральное вспомогательное вещество , которое объединяет функциональность амида Вайнреба с функциональностью вспомогательного вещества псевдоэфедрина Майерса , что позволяет проводить диастереоселективное алкилирование енолята с последующим легким расщеплением до соответствующего энантиообогащенного альдегида или кетона. [14]