Антагонисты нейрокинина 1 (NK 1 ) (-питанты) представляют собой новый класс лекарственных средств, обладающих уникальными антидепрессантными , [1] [2] анксиолитическими , [3] и противорвотными свойствами. Антагонисты NK-1 усиливают эффективность антагонистов 5-HT3 для предотвращения тошноты и рвоты. Открытие антагонистов рецепторов нейрокинина 1 ( NK 1 ) стало поворотным моментом в профилактике тошноты и рвоты, связанных с химиотерапией рака. [4]
Примером препарата этого класса является апрепитант . Рвота , вызванная химиотерапией, по-видимому, состоит из острой и отсроченной фаз. До сих пор острая фаза рвоты реагирует на антагонисты 5-HT 3 , в то время как отсроченная фаза остается трудно поддающейся контролю. Открытие и разработка антагонистов рецепторов NK 1 вызвали противорвотный эффект как в острой, так и особенно в отсроченной фазе рвоты. [5] Касопитант , нетупитант и ролапитант являются некоторыми новыми дополнениями в этой группе. Ролапитант имеет значительно более длительный период полувыведения - 160 часов и был одобрен FDA США в 2015 году.
Первым зарегистрированным клиническим применением антагонистов рецепторов NK 1 было лечение рвоты, связанной с химиотерапией рака . [6]
В 1931 году фон Эйлер и Гаддум обнаружили вещество P (SP) в мозге и кишечнике лошади. Вещество проявило сильное сосудорасширяющее действие и сократительную активность в кишечнике кролика. Были приложены большие усилия для очистки этого вещества из различных тканей млекопитающих, но 30 лет исследований не увенчались успехом. Пептиды немлекопитающих , которые вызывали те же сосудорасширяющие и сократительные эффекты, что и SP, были обнаружены Эрспамером в начале 1960-х годов. Эти пептиды имели общую последовательность C-конца и были сгруппированы вместе как тахикинины . В 1971 году Чангу удалось очистить SP из кишечника лошади и определить его аминокислотную последовательность; затем SP был классифицирован как тахикинин млекопитающих . Позже стало ясно, что SP является нейропептидом , который распространен в центральной и периферической нервной системе . В середине 1980-х годов были обнаружены дополнительные тахикинины млекопитающих нейрокинин A (NKA) и нейрокинин B (NKB). [7] [8] Это привело к дальнейшим исследованиям, в результате которых были выделены гены, кодирующие тахикинины млекопитающих, и в конечном итоге открыто три различных рецептора тахикинина. В 1984 году было решено, что рецепторы тахикинина следует называть рецептором тахикинина NK 1 , рецептором тахикинина NK 2 и рецептором тахикинина NK 3. [7] [9]
Биологические исследования , которые выявили множество функций тахикининов, вызвали интерес к разработке антагонистов нейрокининовых рецепторов . [8] В 1980-х годах несколько пептидных антагонистов, полученных из SP, были первыми антагонистами рецепторов NK 1. Однако эти соединения, как и большинство пептидных соединений, имели проблемы с селективностью , эффективностью , растворимостью и биодоступностью . По этой причине фармацевтические компании сосредоточились на разработке непептидных антагонистов рецепторов NK 1 , и в 1991 году три разные компании представили свои первые результаты. С тех пор непептидные антагонисты рецепторов NK 1 были широко исследованы, и появилось много структур и патентов . Предложив концепцию в начале 1990-х годов, в 1998 году Крамер и др. сообщили о клинических данных об эффективности и безопасности MK-869 (апрепитанта) у пациентов с большим депрессивным расстройством. [1] В 2003 году первый антагонист рецептора NK 1 , апрепитант (Эменд), получил одобрение на продажу от Управления по контролю за продуктами и лекарствами США (FDA). [10] [11] [12]
Тахикинины — это семейство нейропептидов , которые имеют одинаковую гидрофобную С-концевую область с аминокислотной последовательностью Phe -X- Gly - Leu - Met -NH 2 , где X представляет собой гидрофобный остаток, который является либо ароматическим , либо бета-разветвленным алифатическим . N-концевая область различается у разных тахикининов. [13] [14] [15] Термин тахикинин происходит от быстрого начала действия, вызываемого пептидами в гладких мышцах. [15] SP — наиболее изученный и мощный член семейства тахикининов. Это ундекапептид с аминокислотной последовательностью Arg - Pro - Lys - Pro - Gln - Gln - Phe - Phe - Gly - Leu - Met -NH 2 . [13] SP связывается со всеми тремя рецепторами тахикинина, но сильнее всего он связывается с рецептором NK 1. [14]
Рецептор тахикинина NK 1 , часто называемый просто рецептором NK 1 , является членом семейства 1 ( родопсин -подобных) рецепторов, сопряженных с G-белком , и связывается с белком G αq . [8] Рецептор NK 1 состоит из 407 аминокислотных остатков и имеет молекулярную массу 58 000. [13] [16] Рецептор NK 1 , как и другие рецепторы тахикинина, состоит из семи гидрофобных трансмембранных (ТМ) доменов с тремя внеклеточными и тремя внутриклеточными петлями, аминоконцом и цитоплазматическим карбоксиконцом . Петли имеют функциональные участки, включая две аминокислоты цистеина для дисульфидного мостика , Asp - Arg - Tyr , который отвечает за ассоциацию с аррестином , и Lys / Arg - Lys / Arg -XX- Lys / Arg , который взаимодействует с G-белками . [8] [16]



В 1991 году три разные группы исследовали различные антагонисты рецептора NK 1 путем скрининга химических коллекций. Eastman Kodak и Sterling Winthrop открыли стероидную серию антагонистов рецептора тахикинина NK 1 , которые давали некоторые соединения, но не имели достаточного сродства к рецептору NK 1 , несмотря на проведенные исследования связи структура-активность (SAR). Эта серия оказалась весьма токсичной. Несмотря на то, что было синтезировано множество производных стероидных соединений, биологическая активность не была улучшена. [12] [17]
Рон-Пуленк открыл соединение RP-67580, которое имеет высокое сродство к рецептору NK 1 у крыс и мышей, но не у людей. Исследования SAR, которые были проведены с целью улучшения селективности к человеческому рецептору NK 1 , привели к разработке соединения под названием RPR-100893. Это соединение показало хорошую активность in vivo и в моделях боли и было разработано до фазы II для лечения мигрени, но затем прекращено, как и в случае с другими антагонистами рецептора NK 1 , которые были испытаны для того же показания. [12] [17]
Третья компания, Pfizer , открыла структуру бензиламинохинуклидина , которая была названа CP-96345 (рисунок 1). CP-96345 имеет довольно простую структуру, состоящую из жесткого хинуклидинового каркаса, содержащего основной атом азота, бензгидрильную часть и о-метоксибензиламиновую группу. Это соединение показало высокое сродство к рецептору NK 1 , но оно также взаимодействовало с участками связывания Ca 2+ . Считалось, что сильноосновный азот хинуклидина в соединении отвечает за это связывание Ca 2+ , что вызвало ряд системных эффектов, не связанных с блокированием рецептора NK 1. По этой причине, а также для упрощения структуры, было проведено алкилирование в этом участке для получения аналогов.
Соединение CP-99994 было синтезировано путем замены хинуклидинового кольца на пиперидиновое кольцо и бензгидрильной группы на бензильную группу (рисунок 2). [12] [17] CP-99994 имел высокое сродство к человеческому рецептору NK 1 , и это положило начало большому количеству исследований структуры и активности, каждое из которых было направлено на выявление структурных требований для высокоаффинного взаимодействия с рецептором NK 1 , а также на то, чтобы сделать молекулу еще проще и улучшить ее химико-физические и фармакологические свойства. [17] CP-99994 облегчил зубную боль у людей и вошел во II фазу клинических испытаний; они были прекращены из-за плохой биодоступности. Pfizer исследовал несколько других родственных антагонистов рецептора NK 1 . CJ-11974, также называемый эзлопитантом, был близким аналогом CP-96345, который имел изопропиловую группу в метоксибензиловом кольце. Он был разработан до фазы II клинических испытаний для рвоты, вызванной химиотерапией, прежде чем разработка была прекращена. CP-122721 был аналогом CP-99994, который имел трифторметоксигруппу в о-метоксибензиловом кольце. Он вошел во II фазу испытаний для лечения депрессии, рвоты и воспалительных заболеваний, но о дальнейшей разработке не сообщалось. [12]
В 1993 году компания Merck начала проводить исследования SAR антагонистов рецептора NK 1 на основе как CP-96345, так и CP-99994. L-733,060 является одним из соединений, которые были разработаны на основе CP-99994. Он имеет 3,5-бистрифторметилбензилэфир пиперидин вместо фрагмента 2- метоксибензиламина соединения CP-99994. Для улучшения пероральной биодоступности азот пиперидина был функционализирован с целью снижения его основной природы. Группа, которая дала наилучшие эффекты на основность, была фрагментом 3-оксо-1,2,4-триазол-5-ила, и она дала такие соединения, как L-741671 и L-742694. Было обнаружено, что морфолиновое ядро, которое было введено в L-742694, усиливает сродство связывания NK 1 . [11] Это ядро было сохранено в дальнейших модификациях. Чтобы предотвратить возможную метаболическую дезактивацию, были введены несколько усовершенствований, таких как метилирование C alfa бензильного кольца и фторирование фенильного кольца . Эти изменения дали соединение MK-869, которое показало высокое сродство к рецептору NK 1 и высокую пероральную активность (рисунок 3). MK-869 также называется апрепитантом и изучался при боли, мигрени, рвоте и психиатрических расстройствах. Эти исследования привели к одобренному FDA препарату Emend для тошноты и рвоты, вызванных химиотерапией, и он доступен для перорального применения. [12] Водорастворимое фосфорильное пролекарство для внутривенного применения, называемое фосапрепитантом , также доступно и продается как Ivemend. [18] Апрепитант также считался эффективным при лечении депрессии. Он вошел в фазу III испытаний, прежде чем разработка для этого показания была прекращена. [12]


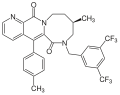
Многие соединения были описаны различными фармацевтическими компаниями, помимо соединений, которые привели к открытию апрепитанта. GR-205171 (рисунок 4) был разработан Glaxo и был основан на CP-99994. GR-205171 имел тетразольное кольцо в положении 4 бензильного кольца CP-99994, которое было предназначено для увеличения пероральной биодоступности и улучшения фармакокинетических свойств. Он был разработан до фазы II клинических испытаний для лечения послеоперационной тошноты и рвоты, мигрени и укачивания. Он показал хорошие результаты при рвоте , но разработка была прекращена. [12]
LY-303870, или ланепитант (рисунок 5), представляет собой N-ацетилированный восстановленный амид L-триптофана , который был открыт Eli Lilly . Он прошел фазу IIa клинических испытаний для лечения боли при остеоартрите, но не показал существенных эффектов. Eli Lilly провела некоторую работу SAR по его структуре и разработала некоторые соединения, которые не вошли в клинические испытания. [12]
Согласно общей гипотезе о сайте связывания пептидных рецепторов, сопряженных с G-белком , Takeda открыла серию N-бензилкарбоксиамидов в 1995 году. Одно из этих соединений, TAK-637 (рисунок 6), прошло клинические испытания фазы II для лечения недержания мочи, депрессии и синдрома раздраженного кишечника, но разработка была прекращена. Есть еще другие соединения, которые были исследованы в прошлом и даже достигли клинических испытаний, и исследования продолжаются, несмотря на отсутствие успеха в клинических испытаниях. [11] [12]
На рецепторе NK 1 имеется более одного домена связывания лиганда для непептидных антагонистов , и эти домены связывания можно найти в разных местах. Основной сайт связывания лиганда находится в гидрофобном ядре между петлями и внешними сегментами трансмембранных доменов 3–7 (TM3–TM7). [16] Несколько остатков, таких как Gln 165 (TM4), His 197 (TM5), His265 (TM6) и Tyr 287 (TM7), участвуют в связывании многих непептидных антагонистов рецепторов NK 1. [7] [16] Было заявлено, что замена His197 на Ala снижает сродство связывания CP-96345 с рецептором NK 1. His197 взаимодействует с бензгидрильной группой CP-96345. Эксперименты показали, что замена Val 116 (TM3) и Ile 290 (TM7) снижает сродство связывания CP-96345. Данные указывают на то, что эти остатки, вероятно, не взаимодействуют с антагонистами, но скорее косвенно влияют на общую конформацию сайта связывания антагониста. Остаток Gln 165 (TM4) также оказался значимым для связывания нескольких непептидных антагонистов, возможно, посредством образования водородной связи . [17] [19] Phe 268 и Tyr 287 были предложены в качестве возможных точек контакта для доменов связывания как агониста, так и антагониста. [16]
Значимость His265 была подтверждена в связывании антагонистов с рецептором NK 1. His265 благоприятно взаимодействует с 3,5-бис-трифторметилфенильной группой (группой TFMP) аналога CP-96345. Тем не менее, было показано, что замена His265 на Ala не влияет на связывающую способность CP-96345. [11]
Некоторые другие остатки, которые, как полагают, участвуют в связывании непептидных антагонистов с рецептором NK 1, — это Ser 169, Glu 193, Lys 194, Phe 264, Phe 267, Pro 271 и Tyr 272. Каждый структурный класс непептидных антагонистов рецептора NK 1 , по-видимому, взаимодействует с определенным набором остатков в общем связывающем кармане. [7] [16]
Существует по крайней мере три основных элемента, которые важны для взаимодействия лиганда с рецептором NK 1. Во-первых, взаимодействие ионно-парного сайта с азотом мостика; во-вторых, взаимодействие дополнительного сайта связывания с бензгидрильной группой; и, в-третьих, специфическое взаимодействие сайта с (2-метоксибензил) амино боковой цепью. Исследования показали, что соединения с пиперидиновым кольцом обладают селективностью к рецептору NK 1 по сравнению с рецепторами NK 2 , NK 3 , опиоидными и 5-HT . Добавляя группу N-гетероарил-2-фенил-3-(бензилокси) к пиперидину , получается селективный антагонист рецептора NK 1. Исследования также показали, что двугранный угол между группами на C-2 и C-3 в CP-99994 имеет решающее значение для активности антагонистов рецептора NK 1 . [15] Предполагается, что основной азот мостика взаимодействует с рецептором NK 1 , опосредуя его распознавание через сайт ионной пары. [20] Было обнаружено, что основные атомы азота в пиридо[3,4-b]пиридине действительно имеют функцию закрепления в фосфолипидном компоненте клеточной мембраны. [15]
При разработке MK-869 было обнаружено, что 3,5-дизамещение бензильного кольца в ряду эфира дало большую эффективность, чем 2-метоксизамещение в более ранних структурах бензиламина . Также было обнаружено, что группа TFMP оказалась особенно важной, и считается, что она усиливает активность in vivo и улучшает метаболизм. Другие группы, такие как орто-метоксифенильная группа, могут быть важны в определенных случаях, но, как полагают, играют большую роль в предварительной организации лиганда посредством внутримолекулярного водородного связывания, а не посредством прямого взаимодействия с остатком сайта связывания. [11] Наличие внутримолекулярного π–π-взаимодействия лицом к лицу между двумя ароматическими кольцами является общей чертой высокоаффинных антагонистов рецептора NK 1. Считается, что эта особенность важна для стабилизации биоактивной конформации. Это взаимодействие может быть усилено с помощью конформационно ограниченной системы, такой как восьмичленное кольцо, введенное в нафтиридиновое кольцо. [20]

Рвота , вызванная химиотерапией, является серьезной проблемой в лечении рака. Для этой цели изучается новое соединение T-2328 (рисунок 7), непептидный антагонист семейства тахикининов NK 1. T-2328 вводится внутривенно и лечит как острую, так и отсроченную рвоту. Предполагается, что его противорвотное действие осуществляется посредством воздействия на мозговые рецепторы NK 1. T-2328 очень эффективен; константа ингибирования находится в субнаномолярном диапазоне и в 16 раз ниже, чем у апрепитанта. Ингибирование является высокоселективным для рецепторов NK 1 .
Рецепторы NK 2 и NK 3 также являются мишенями для новых классов лекарств, а также демонстрируют выраженные антидепрессивные и анксиолитические эффекты. [21] Исследования показали, что константа ингибирования (Ki) для рецепторов NK 2 была >10000 раз выше, а для рецепторов NK 3 >1000 раз выше, чем для рецепторов NK 1. Сродство также было намного ниже для рецепторов NK 2 и NK 3. [5] С тех пор как были обнаружены тахикинины , было показано, что они обладают биологической активностью в ряде патологических и физиологических систем. Тем не менее, терапевтический потенциал антагонистов тахикинина не был полностью изучен. [6]
{{citation}}: CS1 maint: DOI неактивен по состоянию на октябрь 2024 г. ( ссылка )