N -Ацил-гомосерин-лактоны (сокращенно AHL или N-AHL) представляют собой класс сигнальных молекул , участвующих в распознавании бактериального кворума , средствах связи между бактериями, обеспечивающих поведение, основанное на плотности популяции.
Первый АГЛ (N-3-(оксо-гексаноил)-гомосерин лактон) был обнаружен как природный индуктор биолюминесценции у бактерии Vibrio fischeri . [1] Ощущение кворума с помощью АГЛ способствует регулированию транскрипции конкретных генов и, следовательно, экспрессии определенных фенотипов, включая рост, вирулентность , образование биопленок , биолюминесценцию, выработку экзополисахарида (ЭПС). [2] Более 50 видов грамотрицательных бактерий (включая несколько патогенных видов) используют АГЛ в качестве аутоиндукторов и средства их коммуникации при определении кворума. В одном исследовании было показано, что АГЛ взаимодействует с эукариотическими клетками, смягчает иммунный ответ и облегчает инфекцию. [3] АГЛ являются одной из основных групп молекул аутоиндукторов (АИ), которые обнаруживаются преимущественно у грамотрицательных протеобактерий, а также у некоторых бактериодетов, цианобактерий и архей. [4] Две другие основные группы представляют собой олигопептиды AI в грамположительных бактериях ; и аутоиндуктор-2 (АИ-2) как универсальный сигнал межвидовой коммуникации. [5]
Он возникает в результате реакции ацильных белков-переносчиков с S-аденозилметионином. Последний является донором эквивалента 4- аминобутиролактона . Метилтиоаденозин является побочным продуктом . [6]
Гомосеринлактон также является продуктом протеолитической реакции бромциана (CNBr) с остатком метионина . Эта реакция важна для химического секвенирования белков.
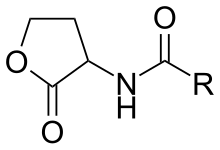
АГЛ имеют гидрофобный и гидрофильный участки. Гидрофильная часть состоит из лактонного кольца гомосерина и амидной группы. Гидрофобный участок имеет штаммоспецифичную углеводородную цепь, различающуюся по длине и уровню оксигенации 3-оксогруппой. Длина ацильной цепи обычно составляет от 4 до 18 атомов углерода. Длина переменной боковой цепи R-группы . Длины цепей варьируются от 4 до 18 атомов углерода и при замещении карбонила у третьего углерода. [7] Гидрофильные участки образуют сеть водородных связей внутри сайта связывания рецептора, в то время как гидрофобные участки способствуют диффузионным и связывающим свойствам внутри гидрофобного кармана. [8] Исследования еще не продемонстрировали корреляцию между ферментами АГЛ-синтазы и типом АГЛ. Белок LuxI синтезирует ацилированную молекулу гомосерин-лактона. Ген LuxI высококонсервативен, что указывает на то, что, несмотря на разнообразие, существует ограниченное количество сигналов типа АГЛ, которые продуцируются бактериями. Однако в семействе ферментов AHL-синтазы С-концевая область, которая определяет тип субстратов, которые может распознавать синтетаза, и последующую длину ацильной цепи, не консервативна. Более того, на данный момент нет доказательств того, что распределение синтазы AHL и виды коррелируют. [9] В отличие от генов LuxI, рецепторы АГЛ, белок LuxR и их гены сильно различаются среди видов.
Передача сигналов бактериального кворума начинается с того, что N-AHL секретируются в окружающую среду.
В процессе ощущения кворума сначала белок LuxI синтезирует ацилированную молекулу гомосерин-лактона, которая может проходить через клеточную мембрану по градиенту за счет диффузии в окружающее пространство. Когда концентрация этих аутоиндукторов в окружающей среде ниже, чем внутри клетки, они сдвинутся вниз по градиенту и покинут клетку, следовательно, не прикрепятся к своему рецептору LuxR, находящемуся в цитоплазме. Когда популяция бактерий достигает порога, а концентрация аутоиндукторов в среде выше, чем внутри клетки, они перемещаются по градиенту внутрь клетки и прикрепляются к рецептору. Таким образом, будет сформирован комплекс ЛюксР-АГЛ. [10] Этот комплекс будет связываться с участком ДНК длиной 20 пар оснований (п.н.), называемым люкс- боксом. Эта область находится внутри или рядом с областью промотора lux , которая расположена примерно на 40 п.н. выше регулируемого гена. Поскольку LuxR связан с промотором, РНК-полимераза рекрутируется в эту область промотора и индуцируется экспрессия гена. [11] Более того, комплекс LuxR-AHL будет активировать транскрипцию белка LuxI, что увеличит выработку AHL (петля положительной обратной связи). Транскрипция целевых генов будет регулироваться, а экспрессия генов во всей популяции будет координироваться. [12] В нескольких исследованиях изучались потенциальные АГЛ, эффективные при инфекциях и устойчивости к антибиотикам. Система LuxR-LuxI, опосредованная АГЛ, является наиболее проверенной системой QS для видов бактерий с множественной лекарственной устойчивостью. [13]
В отличие от ощущения кворума, подавление кворума предотвращает бактериальную коммуникацию и влияет на экспрессию их генов. Мишенью тушения кворума являются сигнальные молекулы, биосинтетический аппарат сигнальных молекул и регуляторные белки, воспринимающие эти сигнальные молекулы, при этом основным механизмом является деградация АГЛ посредством ферментов, разрушающих АГЛ, и ограничение накопления сигнала. АГЛ разлагаются ферментами по трем механизмам: гидролиз лактона, гидролиз амидной связи и модификация ацильной цепи. Гидролиз лактона происходит, когда лактоназа AHL гидролизует лактоновые кольца гомосерина. Этот процесс впервые наблюдался у видов Bacillus . Ацилазы АГЛ катализируют полное и необратимое разрушение АГЛ за счет гидролиза амидных связей. Оксидаза и редуктаза АГЛ, впервые обнаруженные у Rhodococcus erythropolis, катализируют изменение химической структуры сигналов, что влияет на распознавание сигналов АГЛ и препятствует регулируемым процессам определения кворума. Вторая AHLаза представляет собой монооксигеназу Bacillus megaterium P450, которая окисляет жирные кислоты и N-жирные ациламинокислоты. Лактоназы и ацилазы являются пионерами механизмов тушения кворума. Лактоназы разрушают лактонные связи в аутоиндукторах, делая их неспособными связываться с целевыми регуляторами транскрипции и тем самым повышая устойчивость к болезням. [14]
Растения играют решающую роль в формировании нашего мира, и их взаимоотношения с микроорганизмами имеют большое значение. За долгую историю совместной эволюции растений и микробов растения эволюционировали, чтобы реагировать на симбиотические или патогенные микробы соответствующими способами с адаптированным профилем экспрессии генов, таким как сотрудничество с бактериальными сапротрофами, что приводит к эндофитной жизни или защитным реакциям против патогенов. АГЛ играют важную роль в симбиозе ризобий и бобовых, что приводит к образованию клубеньков. [15] Эксперименты показали, что применение АГЛ активирует ответственный за ауксин промотор GH3 (усиливает регуляцию генов, связанных с ауксином), и подавляет гены, связанные с цитокинином (изменение соотношения между ауксином и цитокинином может способствовать росту). [16] Кроме того, после применения AHL узелковость в корнях усилилась. [17] Более того, поток воды и минералов через растение был выше по мере увеличения открытия устьиц, и, следовательно, общая скорость транспирации изменилась. [18] Было показано, что помимо полезных взаимодействий бактерий и растений, опосредованных AHL, соединения AHL, передающие QS-сигналы, действуют как важный коммуникационный сигнал в трехсторонних симбиотических взаимодействиях бактерия-гриб-растение. Эндофитная бактерия с аутоиндукцией АГЛ и продуцирование различных АГЛ с длинной боковой цепью, по-видимому, помогает грибу симбиотически взаимодействовать с колонизированными растениями-хозяевами. Гриб Serendipita indica, выделенный из ризосферы растений, связан с устойчивостью к стрессу и стимулированием роста растений. Показано, что этот гриб содержит эндогрибковую бактерию Rhizobium radiobacter F4, обладающую генами АГЛ-аутоиндукции. Когда R. radiobacter F4 был инокулирован Arabidopsis или пшенице ( Triticum aestivum ), это вызывало аналогичную стимуляцию роста и урожайности, а также запуск защитных реакций и повышение экологической приспособленности. Интересно, что когда соединения АГЛ были истощены, колонизация корней, стимулирование роста и активность, вызывающая устойчивость, уменьшались. Эти результаты позволяют предположить, что всякий раз, когда гриб S. indica применяется для поддержания энергии роста различных растений, эндогрибковые R. radiobacter , продуцирующие АГЛ , колонизируют растение-хозяин и участвуют в координации взаимодействия микробов и растений. [19]
Микробы являются ключевым игроком, отвечающим за судьбу азота в почве и воде. Опосредованное АГЛ ощущение кворума играет важную роль в азотном цикле. Все нитрифицирующие бактерии и некоторые денитрифицирующие бактерии используют АГЛ в качестве сигнальных молекул. [20] АГЛ влияют на эффективность и регулируют функции, участвующие в нитрификации и денитрификации. Некоторые виды бактерий, окисляющих аммиак, такие как Nitrosomonas europaea, Nitrosospira multiformis, Nitrosospira briensis , используют C6-C14-AHL. Нитритоокисляющие бактерии (НОБ), такие как Nitrobacter winogradskyi, Nitrobacter vulgaris и Nitrospira moscoviensis, также используют C8- или C10-AHL . Candidatus Jettenia caeni с режимом анаэробного окисления аммония (аннамокс) использует C6- и C8-AHL. Более того, Pseudomonas aeruginosa и Paracoccus denitrificans в качестве денитрифицирующих бактерий также используют C4-HSL и C16-AHL соответственно. У некоторых нитрифицирующих и денитрифицирующих бактерий, таких как Nitrobacter hamburgensis, АГЛ не были обнаружены, хотя предполагаемая синтетаза и рецепторные белки АГЛ были обнаружены. [9]