Митохондриальный биогенез — это процесс, посредством которого клетки увеличивают количество митохондрий . [1] [2] Впервые он был описан Джоном Холлоши в 1960-х годах, когда было обнаружено, что физические тренировки на выносливость вызывают более высокий уровень содержания митохондрий, что приводит к большему усвоению глюкозы мышцами. [3] Митохондриальный биогенез активируется многочисленными различными сигналами во время клеточного стресса или в ответ на внешние стимулы, такие как аэробные упражнения . [1] [2] [4]
Способность митохондрии к саморепликации коренится в ее эволюционной истории. Обычно считается, что митохондрии произошли от клеток, которые сформировали эндосимбиотические отношения с α-протобактериями ; у них есть свой собственный геном для репликации. [5] Однако недавние данные свидетельствуют о том, что митохондрии могли эволюционировать без симбиоза. [6] Митохондрия является ключевым регулятором метаболической активности клетки, а также важной органеллой как в производстве, так и в деградации свободных радикалов. [7] Предполагается, что большее число копий митохондрий (или большая масса митохондрий) защищает клетку.
Митохондрии производятся в результате транскрипции и трансляции генов как в ядерном геноме, так и в митохондриальном геноме . Большая часть митохондриального белка поступает из ядерного генома, в то время как митохондриальный геном кодирует части цепи переноса электронов вместе с митохондриальной рРНК и тРНК . Митохондриальный биогенез увеличивает метаболические ферменты для гликолиза, окислительного фосфорилирования и, в конечном счете, большую метаболическую емкость митохондрий. Однако, в зависимости от доступных энергетических субстратов и окислительно-восстановительного состояния клетки, клетка может увеличивать или уменьшать количество и размер митохондрий. [8] Критически важно, что количество и морфология митохондрий варьируются в зависимости от типа клетки и контекстно-специфических потребностей, в результате чего баланс между слиянием/делением митохондрий регулирует распределение, морфологию и функцию митохондрий. [9] [8]
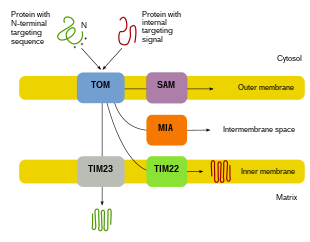
Поскольку большая часть митохондриального белка поступает из ядерного генома, для выполнения своих функций белки должны быть правильно нацелены и транспортированы в митохондрии. [8] [10] [11] Сначала мРНК транслируется в цитозоле клетки. [10] [11] Полученные развернутые белки-предшественники затем смогут достичь своих соответствующих митохондриальных отсеков. [11] [10] Белки-предшественники будут транспортироваться в одну из четырех областей митохондрий, которые включают внешнюю мембрану, внутреннюю мембрану, межмембранное пространство и матрикс. [10] [11] Все белки будут попадать в митохондрии с помощью транслоказы на внешней митохондриальной мембране (TOM). [11] [10] [5] Некоторые белки будут иметь N-концевой сигнал нацеливания, и эти белки будут обнаружены и транспортированы в матрикс, где они затем будут расщеплены и свернуты. [12] [11] [10] Другие белки могут иметь целевую информацию в своих последовательностях и не будут включать N-концевой сигнал. [11] [10] За последние два десятилетия исследователи обнаружили более тридцати белков, которые участвуют в импорте митохондриальных белков. [11] По мере того, как исследователи узнают больше об этих белках и о том, как они достигают соответствующих митохондриальных компартментов, которые их используют, становится очевидным, что существует множество процессов, которые работают вместе в клетке, обеспечивая митохондриальный биогенез. [11] [8]
Митохондрии очень универсальны и способны изменять свою форму посредством деления и слияния. [9] [8] Определенно, деление — это событие распада одной сущности, тогда как слияние — это событие объединения двух или более сущностей для формирования целого. [8] Процессы деления и слияния противостоят друг другу и позволяют митохондриальной сети постоянно перестраиваться. [9] [8] Если стимул вызывает изменение баланса деления и слияния в клетке, он может значительно изменить митохондриальную сеть. [9] [13] Например, увеличение деления митохондрий приведет к созданию множества фрагментированных митохондрий, что, как было показано, полезно для устранения поврежденных митохондрий и для создания меньших митохондрий для эффективной транспортировки в области, требующие энергии. [13] [14] Таким образом, достижение баланса между этими механизмами позволяет клетке иметь правильную организацию своей митохондриальной сети во время биогенеза и может играть важную роль в адаптации мышц к физиологическому стрессу. [13]
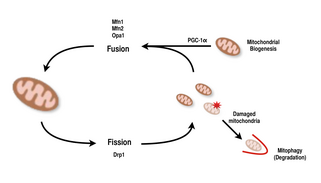
У млекопитающих слияние и деление митохондрий контролируются ГТФазами семейства динаминов . [8] [13] Процесс деления митохондрий направляется Drp1 , членом семейства цитозольных динаминов. [8] [9] Этот белок образует спираль вокруг митохондрий и сужается, чтобы разорвать как внешнюю, так и внутреннюю мембраны органеллы. [14] С другой стороны, процесс слияния направляется различными мембранно-закрепленными белками динаминов на разных уровнях митохондрий. [13] Слияние на уровне внешней митохондриальной мембраны опосредуется Mfn1 и Mfn2 (митофузины 1 и 2), [15] а слияние на уровне внутренней митохондриальной мембраны опосредуется Opa1 . [8] [12] [13] Многочисленные исследования выявили коррелированное увеличение дыхательной способности митохондрий с экспрессией генов Mfn1, Mnf2 и Drp1 после упражнений на выносливость. [14] [15] Таким образом, подтверждается, что реорганизация митохондриальной сети в мышечных клетках играет важную роль в ответ на упражнения. [4] [13] [15]
PGC-1α , член семейства транскрипционных коактиваторов рецепторов, активируемых пролифераторами пероксисом гамма (PGC) , является главным регулятором митохондриального биогенеза. [1] [2] [16] Известно, что он коактивирует ядерный респираторный фактор 2 (NRF2/GABPA) и вместе с NRF-2 коактивирует ядерный респираторный фактор 1 ( NRF1 ). [15] [16] NRF, в свою очередь, активируют митохондриальный фактор транскрипции A (tfam) , который напрямую отвечает за транскрипцию кодируемых ядром митохондриальных белков. [15] [16] Сюда входят как структурные митохондриальные белки, так и те, которые участвуют в транскрипции, трансляции и восстановлении мтДНК . [16] PGC-1β, белок, структурно похожий на PGC-1α , также участвует в регуляции биогенеза митохондрий, но отличается тем, что его уровень не увеличивается в ответ на физические упражнения. [5] [17] [16] Хотя в тканях, где наблюдается повышенная экспрессия PGC-1α, было обнаружено значительное увеличение количества митохондрий, поскольку кофактор взаимодействует с этими ключевыми факторами транскрипции, мыши с нокаутом и нарушенным PGC-1α по-прежнему жизнеспособны и демонстрируют нормальное количество митохондрий. [17] [5] [16] Таким образом, PGC-1α не требуется для нормального развития митохондрий у мышей, но при физиологическом стрессе эти мыши демонстрируют сниженную толерантность по сравнению с мышами с нормальным уровнем PGC-1α. [5] [16] [17] Аналогично, у мышей с нокаутом и нарушенным PGC-1β мыши показали в основном нормальный уровень митохондриальной функции с пониженной способностью адаптироваться к физиологическому стрессу. [18] [5] Однако эксперимент с двойным нокаутом PGC-1α/β создал мышей, которые умирали в основном в течение 24 часов из-за дефектов в созревании митохондрий сердечной ткани. [19] Эти результаты показывают, что, хотя и PGC-1α, и PGC-1β не устанавливают по отдельности способность клетки выполнять митохондриальный биогенез, вместе они способны дополнять друг друга для оптимального созревания и функционирования митохондрий в периоды физиологического стресса. [19] [5] [17]
AMP-активируемая киназа (AMPK) также регулирует митохондриальный биогенез путем фосфорилирования и активации PGC-1α при обнаружении дефицита энергии в мышцах. [5] [16] У мышей со сниженным соотношением АТФ/АМФ, которое может возникнуть во время упражнений, было показано, что истощение энергии коррелирует с активацией AMPK. [5] [18] [16] Затем активация AMPK продолжила активировать PGC-1α и NRF у этих мышей, и митохондриальный биогенез был стимулирован. [5] [18] [16]
Было показано, что способность к митохондриальному биогенезу снижается с возрастом, и такое снижение митохондриальной функции было связано с диабетом и сердечно-сосудистыми заболеваниями. [20] [21] [22] Старение и болезни могут вызывать изменения в уровнях экспрессии белков, участвующих в механизмах деления и слияния митохондрий, тем самым создавая дисфункциональные митохондрии. [23] [24] Одна из гипотез пагубных результатов старения связана с потерей теломер , конечных сегментов хромосом, которые защищают генетическую информацию от деградации. [21] [24] Потеря теломер также была связана со снижением митохондриальной функции. [24] [21] Дефицит обратной транскриптазы теломеразы (TERT) , фермента, который играет роль в сохранении теломер, был связан с активированным p53, белком, который подавляет PGC-1α. [24] [23] [21] Таким образом, потеря теломер и TERT, которая происходит со старением, связана с нарушением митохондриального биогенеза. [21] [23] [24] Также было показано, что экспрессия AMPK уменьшается с возрастом, что также может способствовать подавлению митохондриального биогенеза. [5] [24]
Митохондриальный биогенез может быть направлен на предотвращение пролиферации рака. В частности, два регулятора биогенеза — PGC1α и c-Myc — могут быть направлены на предотвращение пролиферации рака. PGC1α является ключевым компонентом в митохондриальном биогенезе — как транскрипционный коактиватор, он нацелен на несколько факторов транскрипции и эстроген-связанный рецептор альфа (ERRα). [25] Было обнаружено , что соединения, нацеленные на путь между PGC1α и ERRα, такие как обратный агонист ERRα, XCT-790 , значительно снижают митохондриальный биогенез, тем самым значительно снижая пролиферацию раковых клеток и увеличивая их чувствительность к химиотерапевтическим агентам. [26] c-Myc, фактор транскрипции, может быть ингибирован во время его димеризации с белком Max такими молекулами, как IIA6B17 [27] и omomyc. [28] Ингибирование комплекса c-Myc-Max может блокировать клеточный цикл и вызывать апоптоз в раковых клетках.