
В органической химии восстановление карбонила представляет собой преобразование любой карбонильной группы, обычно в спирт. Это распространенное преобразование, которое практикуется многими способами. [1] Кетоны , альдегиды , карбоновые кислоты , сложные эфиры , амиды и галогенангидриды — некоторые из наиболее распространенных функциональных групп — включают карбонильные соединения. Карбоновые кислоты, сложные эфиры и галогенангидриды могут быть восстановлены либо до альдегидов, либо на шаг дальше до первичных спиртов , в зависимости от силы восстановителя. Альдегиды и кетоны могут быть восстановлены соответственно до первичных и вторичных спиртов . При дезоксигенации спиртовая группа может быть дополнительно восстановлена и полностью удалена путем замены на H.
Существуют две общие стратегии восстановления карбонила. Один метод, который предпочитают в промышленности, использует водород в качестве восстановителя. Этот подход называется гидрогенизацией и требует металлических катализаторов. Другой общий подход использует стехиометрические реагенты, которые доставляют H - и H + по отдельности. В этой статье основное внимание уделяется использованию этих реагентов. Среди этих реагентов выделяются соли щелочных металлов борогидридов и гидридов алюминия.

С точки зрения механизма реакции , гидриды металлов осуществляют нуклеофильное присоединение гидрида к углероду карбонила. Легкость присоединения гидрида к карбонилу зависит от электрофильности и объема карбонила, а также от соответствующих электронных и стерических свойств реагента гидрида. Результатом этих тенденций является то, что галогенангидриды кислот, кетоны и альдегиды обычно являются наиболее легко восстанавливаемыми соединениями, в то время как кислоты и эфиры требуют более сильных восстановителей. Важно и характерно, что эти реагенты гидрида обычно не атакуют связи C=C. [2]
Несколько факторов способствуют прочности металлогидридных восстановителей. Восстановительная способность боргидридных реагентов зависит от противоиона , такого как Na + против Li +, который может активировать карбонилы, координируясь с карбонильным кислородом. Li + связывается с карбонильным кислородом сильнее, чем Na + . [3] Однако в случае тетрагидроалюминатов NaAlH 4 и LiAlH 4 ведут себя аналогично. [2] Были исследованы многие металлические добавки. Например, боргидрид цинка, номинально Zn(BH 4 ) 2 , используется для мягкого селективного восстановления альдегидов и кетонов в присутствии других восстанавливаемых групп. [4]
Центральный металл (обычно B против Al) сильно влияет на силу восстановителя. Гидриды алюминия более нуклеофильны и являются лучшими восстановителями по сравнению с борогидридами. [5] Относительно слабый восстановитель борогидрид натрия обычно используется для восстановления кетонов и альдегидов. Он допускает многие функциональные группы (нитрогруппа, нитрил, сложный эфир). [6]
По своим эксплуатационным свойствам литийалюминийгидрид и борогидрид натрия (и их производные) сильно различаются. С NaBH 4 гораздо проще обращаться, чем с LiAlH 4 , он стабилен на воздухе в течение недель. Его можно использовать с водой или этанолом в качестве растворителей, тогда как LiAlH 4 взрывоопасно реагирует с протонными растворителями.
Заместители на боре или алюминии модулируют мощность, селективность и эксплуатационные свойства этих восстановителей. Электроноакцепторные группы, такие как ацетокси и циано, снижают восстановительную способность, так что NaBH(OAc) 3 и NaBH 3 (CN) являются слабыми восстановителями. Электронодонорные группы, такие как алкильные группы, усиливают восстановительную силу. супергидрид (триэтилборогидрид лития) и L-селектрид являются сильными восстановителями. Они соответственно опасны в обращении.
В следующей таблице [7] показано, какие карбонильные функциональные группы могут быть восстановлены с помощью каких восстановителей (некоторые из этих реагентов различаются по эффективности в зависимости от условий реакции):

По сравнению с альдегидами и кетонами, карбоновые кислоты трудно восстанавливаются. Литийалюминийгидрид обычно эффективен. Первый шаг включает депротонирование карбоновой кислоты. Последний шаг в восстановлении карбоновых кислот и эфиров - гидролиз алкоксида алюминия. [8] Эфиры (и амиды ) восстанавливаются легче, чем исходные карбоновые кислоты. Их восстановление дает спирты и амины, соответственно. [9] Идеализированное уравнение для восстановления эфира литийалюминийгидридом имеет вид:
Боргидрид натрия может, при некоторых обстоятельствах, использоваться для восстановления эфира, особенно с добавками. [1]
Образование альдегидов из производных карбоновых кислот является сложной задачей, поскольку более слабые восстановители (NaBH4 ) часто очень медленно восстанавливают сложные эфиры и карбоновые кислоты, тогда как более сильные восстановители (LiAlH4 ) немедленно восстанавливают образовавшийся альдегид до спирта. [10]

При восстановлении Фукуямы карбоновая кислота сначала преобразуется в тиоэфир путем добавления тиола (с механизмом, аналогичным этерификации ). [11] Затем тиоэфир восстанавливается до альдегида с помощью силилгидрида с палладиевым катализатором.
Хлорангидриды кислот могут быть восстановлены до альдегидов с помощью стерически затрудненных доноров гидрида. Восстановитель DIBAL-H (диизобутилалюминийгидрид) часто используется для этой цели, хотя обычно он восстанавливает любой карбонил. DIBAL-H может селективно восстанавливать хлорангидриды кислот до уровня альдегида, если используется только один эквивалент при низких температурах. [12] LiAlH(OtBu) 3 (образованный из LiAlH4 и tBuOH in situ) ведет себя аналогично. [13] Идеализированное уравнение для восстановления хлорангидрида кислоты до альдегида алюмогидридом лития имеет вид:
Традиционный метод образования альдегидов без восстановления до спиртов — с использованием затрудненных гидридов и реактивных карбонилов — ограничен узким диапазоном субстратов и большой зависимостью от условий реакции. Один из обходных путей, чтобы избежать этого метода, — восстановить производное карбоновой кислоты до спирта, а затем окислить спирт обратно до альдегида. Другие альтернативы включают образование тиоэфира или амида Вайнреба, а затем восстановление нового вида до альдегида через восстановление Фукуямы или реакцию Вайнреба соответственно, или использование каталитического гидрирования, как в реакции Розенмунда.
В синтезе кетона Вайнреба ацилхлорид сначала преобразуется в амид Вайнреба, затем обрабатывается металлоорганическим реагентом для образования кетона или литийалюминийгидридом для образования альдегида: [14]

Амид Вайнреба восстанавливается посредством стабильного хелата , а не электрофильного карбонила, который образуется посредством восстановления гидридами металлов; поэтому хелат восстанавливается только один раз, как показано ниже:

Реакция Розенмунда восстанавливает ацилхлориды до альдегидов с использованием газообразного водорода с катализатором палладием на сульфате бария, малая площадь поверхности которого предотвращает чрезмерное восстановление. [15]
Кетоны менее реакционноспособны, чем альдегиды, из-за больших стерических эффектов и из-за того, что дополнительная алкильная группа вносит электронную плотность в связь C=O, делая ее менее электрофильной. [16] Поскольку альдегиды восстанавливаются легче, чем кетоны, для них требуются более мягкие реагенты и более мягкие условия. С другой стороны, карбоновые кислоты, амиды и эфиры являются слабо электрофильными и требуют сильных восстановителей. [17]
Идеализированное уравнение восстановления кетона боргидридом натрия имеет вид:

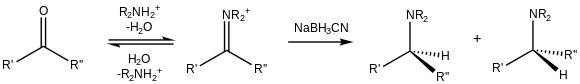
Помимо восстановления до спиртов, альдегиды и кетоны могут быть преобразованы в амины, т.е. восстановительное аминирование. [18] Из-за своего цианозаместителя NaBH 3 CN является слабым восстановителем при умеренном pH (>4), поэтому он предпочтительно восстанавливает катионы иминия, которые существуют в присутствии карбонилов:

При восстановлении α,β-ненасыщенного карбонила могут образоваться три продукта: аллиловый спирт в результате простого восстановления карбонила, насыщенный кетон или альдегид в результате 1,4-восстановления (также называемого сопряженным восстановлением ) или насыщенный спирт в результате двойного восстановления. [19] Использование NaBH4 может дать любой из этих результатов, но InCl3 или NiCl2 катализируют конкретно 1,4-восстановление. [1] Три(втор-бутил)борогидрид калия или лития иногда выбирает 1,4-восстановление, но может быть заблокирован стерическими препятствиями. [20] Кластеры гидрида трифенилфосфиномеди направляют каталитическое гидрирование для выполнения специфически сопряженного восстановления.
Для селективного образования аллилового спирта и избежания продукта 1,4 восстановление Люче использует «борогидрид церия», полученный in situ из NaBH 4 и CeCl 3 (H 2 O) 7 [21] [22] Источник гидрида Zn(BH 4 ) 2 также показывает селективность 1,2, а также большую диастереоселективность. Он делает это, координируясь не только с карбонильным кислородом, но и с соседними атомами: [23]

Частный случай восстановления карбонила влечет за собой полную дезоксигенацию, т. е. гидрогенолиз. Этот результат часто нежелателен, поскольку он включает дефункционализацию.
Некоторые реакции для этого преобразования включают восстановление Клемменсена (в сильнокислых условиях) и восстановление Вольфа-Кишнера (в сильнощелочных условиях), а также различные модификации реакции Вольфа-Кишнера. Модификация Калиоти, например, использует тозилгидразон с донором гидрида в более мягких условиях без основания; [24] модификация Майерса заменяет гидразин на бис(трет-бутилдиметилсилил)-гидразин, использует более мягкие условия при комнатной температуре и является быстрой и эффективной. [25]
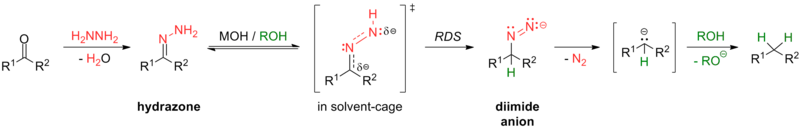
Ароматические карбонилы легче восстанавливаются до соответствующих им алканов, чем алифатические соединения. [26] Например, кетоны восстанавливаются до соответствующих им алкилбензолов путем каталитического гидрирования [27] [28] или путем восстановления по Берчу [29] в мягких условиях.
При восстановлении циклогексанонов источник гидрида может атаковать аксиально, образуя экваториальный спирт, или экваториально, образуя аксиальный спирт. При аксиальной атаке (показано красным) гидрид сталкивается с 1,3-диаксиальным напряжением . При экваториальной атаке (показано синим) гидрид избегает 1,3-диаксиального взаимодействия, но субстрат подвергается неблагоприятному торсионному напряжению , когда вновь образованный спирт и добавленный атом водорода затмевают друг друга в промежуточном продукте реакции (как показано в проекции Ньюмена для аксиального спирта).

Крупные восстановители, такие как LiBH(Me 2 CHCHMe) 3 , затрудняются 1,3-аксиальными взаимодействиями и поэтому атакуют экваториально. [6] Мелкие восстановители, такие как NaBH 4 , предпочтительно атакуют аксиально, чтобы избежать затмевающих взаимодействий, поскольку 1,3-диаксиальное взаимодействие для малых молекул минимально; стереоэлектронные причины также были указаны для аксиального предпочтения мелких восстановителей. [30] Однако увеличение объема субстрата (и увеличение 1,3-аксиальных взаимодействий) снижает распространенность аксиальных атак, даже для небольших доноров гидрида. [31]
При восстановлении асимметричных кетонов образующийся вторичный спирт имеет хиральный центр, который можно контролировать с помощью хиральных катализаторов.
Хорошо известными реакциями восстановления карбонила в асимметрическом синтезе являются асимметрическое гидрирование Нойори (восстановление бета-кетоэфира/Ru/BINAP) и восстановление CBS (BH 3 , хиральный катализатор на основе пролина).
Восстановление Буво -Бланка , использующее смесь металлического натрия в присутствии спиртов, было ранним методом восстановления карбонилов. [32] В настоящее время он в значительной степени устарел. После открытия восстановления Буво-Бланка было разработано много методов, включая крупный прорыв каталитического гидрирования, где H 2 служит восстановителем. [33] Соли гидридов бора и алюминия, открытые начиная с 1940-х годов, оказались весьма удобными реагентами для восстановления карбонилов.
В восстановлении Меервейна-Понндорфа-Верлея изопропоксид алюминия действует как источник гидрида. Статус этой реакции был обобщен таким образом: «синтетический органический химик редко будет пытаться использовать такую традиционную технику, как реакция Меервейна-Понндорфа-Верлея (MPV)». [34]