
Вымирание солончаков — термин, который использовался в США и Великобритании для описания гибели солончаковой травы, ведущей к последующей деградации среды обитания, особенно в низких болотистых зонах солончаков на побережьях Западной Атлантики. Сорбрасс обычно закрепляет осадок в солончаках; его потеря приводит к снижению твердости субстрата, усилению эрозии и обрушению берегов ручьев в воду, что в конечном итоге приводит к ухудшению здоровья и продуктивности болота.
Отмирание может затронуть несколько видов кордграсса (род Spartina ), включая S. alterniflora , S. densiflora и S. townsendii . Существует несколько конкурирующих гипотез, предсказывающих причины и механизмы отмирания солончаков по всей западной Атлантике. Эти гипотезы по-разному акцентируют влияние процессов сверху вниз или снизу вверх на отмирание солончаков. В сочетании с отмиранием солончаков высокогорных болот отмирание солончаков представляет собой серьезную угрозу экосистемным услугам , которые болота предоставляют местным прибрежным сообществам.
В свете их влияния на процессы сообщества, поведение и экологические взаимодействия, потребительские взаимодействия являются одними из наиболее широко изучаемых концепций в экологии . По этой причине ученые используют пищевые сети для изображения всех пищевых цепей и трофических отношений в экологическом сообществе .

Пищевые сети могут контролироваться силами, действующими снизу вверх или сверху вниз, которые определяют, регулируются ли структура пищевой сети и динамика популяции питательными веществами (запасом связанного углерода ) и первичной продукцией или высшими хищниками соответственно.
Много энергии теряется при переходе с одного трофического уровня на другой (около 90%); поэтому успех более высоких уровней связан с более низкими и их поставками ресурсов (Линдеман, 1942). [1] Однако на численность и распределение организмов в экосистеме также влияет плотность потребителей, которая ограничивает успешность организмов на более низких трофических уровнях и тем самым влияет на численность этих организмов (Хэрстон и др., 1960). [2]
Многие экологи утверждают, что контроль снизу вверх и контроль сверху вниз не играют одинаково важную роль в структуре и динамике популяций в экосистеме; однако данные свидетельствуют о том, что как восходящие, так и нисходящие силы влияют на структуру пищевых цепей, а также на пространственное и временное обилие и распределение организмов (Бертнесс, 2007) [3] , хотя до конца не ясно, в какой степени каждый из них играет свою роль.
Исторически акцент на контроле снизу вверх во многих экосистемах преобладал в экологической мысли, часто исключая потребительский контроль (Стронг, 1992). [4] Во многих экосистемах, в которых потребительский контроль классически считался тривиальным, доминируют растения (например, леса, луга и солончаки), и они обычно имеют зеленый цвет. Хейрстон и его коллеги предложили противоположную точку зрения в 1960 году, которая подчеркивала потребительский контроль. Они утверждали, что «мир зеленый», потому что более высокие трофические уровни регулируют численность травоядных (Хейрстон и др., 1960). [2]
Критики указывали, что мир не всегда зеленый, и что когда он зеленый, травоядные животные не обязательно играют важную роль в структурировании растительных сообществ (Эрлих и Бирч, 1967). [5] Другие утверждали, что то, что зеленое, не всегда съедобно или достаточно высокого качества, чтобы обеспечить рост популяций травоядных животных (Диксон, 1966, Мердок, 1966). [6] [7] Дебаты продолжаются, но доминирующей точкой зрения экологов остается то, что, хотя потребители влияют на многие аспекты продуктивности растений и экологии, контроль сверху вниз не управляет продуктивностью целых растительных экосистем.
Однако совсем недавно примеры явного контроля потребителя над целыми экосистемами появились в различных местообитаниях, включая озера (Carpenter et al. 1985), [8] реки (Power 1992), [9] и морские (Estes and Duggins 1995) [10] местообитания. Виды растений- основ могут быть заменены другими видами или субстратом, полностью лишенным растительности , а насекомые могут уничтожать целые мангровые заросли (Feller 2002). [11]
Классический пример нисходящих взаимодействий, определяющих структуру и функции сообщества, можно найти в работе Боба Пейна в Вашингтоне, который установил, что удаление морской звезды Pisaster вызвало трофический каскад, в котором популяции мидий ( Mytilus ) резко возросли из-за освобождения от давления хищников (Paine 1966) [12].
Другой влиятельный пример контроля сверху вниз появился в экспериментах Джейн Любченко на скалистых берегах Новой Англии , которые продемонстрировали, что травоядная улитка L. littorea осуществляет контроль над разнообразием и последовательностью водорослевых сообществ приливных бассейнов (Lubchenco и Menge, 1978). [13] Одна из гипотез , возникшая в результате работы Любченко (Little и Kitching, 1996) [14], заключалась в том, что хищничество зеленого краба ( Carcinus maenas ) влияет на водорослевые сообщества скалистых берегов, регулируя численность L. littorea .
Экологи приводят эти примеры как доказательство того, что регулирование со стороны потребителей является более действенным и доминирующим, чем считалось ранее.

В солончаках ранние экологи, такие как Юджин Одум и Джон Тил, зародили современную парадигму «снизу вверх» в экологии, работая на острове Сапело, штат Джорджия (США), где подчеркивалась доминирующая роль физических факторов, таких как температура , соленость и питательные вещества, в регулировании первичной продуктивности растений и структуры экосистемы (Teal 1962, Odum 1971). [15] [16] Экологи отметили, что болотные растения не подвергались интенсивному выпасу и, по-видимому, были относительно несъедобными, и поэтому утверждали, что большинство растений вошли в пищевые цепи солончаков в качестве детрита (Teal 1962). [15] Следствием этой догмы является то, что потребители играют неважную или едва заметную роль в контроле первичной продуктивности солончаков (Smalley 1960, Teal 1962). [15] [17] Эта парадигма была широко принята на протяжении десятилетий и применялась к другим экосистемам, таким как мангровые заросли и заросли морской травы (Бертнесс, 2007 г.), [3] и, таким образом, «укоренилась в концептуальном понимании прибрежных экосистем» (цитата из Бертнесса и Силлимана, 2008 г.; Смолли, 1960 г., Никсона, 1982 г.). [17] [18] [19]
Однако недавние исследования продемонстрировали сильный контроль растительных сообществ в солончаках сверху вниз со стороны широкого круга потребителей, включая улиток , крабов и гусей (Jefferies 1997, Bortolus и Iribarne 1999, Silliman и Bertness 2002, Holdredge et al. 2009). [20] [21] [22] [23] К болотным травоядным также относятся одичавшие лошади (Furbish и Albano 1994), [24] крупный рогатый скот , зайцы , насекомые и грызуны , некоторые из которых способны сильно подавлять рост растений.
Сильный контроль сверху вниз на болотах был продемонстрирован в различных болотных системах. Потребительский контроль осуществляется крабом- грапсидом ( Chasmagnathus granulata ) в солончаках Аргентины и Бразилии на атлантическом побережье Южной Америки (Bortolus and Iribarne 1999). [21] Другие эксперименты в Аргентине способствовали росту объема работ, подтверждающих потребительский контроль на солончаках (Alberti et al. 2007), [25] и также было высказано предположение, что травоядность играет важную роль в юго-западных атлантических болотах (Bortolus and Iribarne 1999, Alberti et al. 2007). [21] [25] Потребители важны не только в малых масштабах, как показали эксперименты в клетках в разных местах (Силлиман и Зиман 2001, Силлиман и Бертнесс 2002, Силлиман и др. 2005), [22] [26] [27], но они также влияют на первичную продуктивность в больших географических районах (Силлиман и Зиман 2001). [26]
Бертнесс и Силлиман также предположили, что, хотя солончаки исторически могли быть ограничены в питательных веществах и контролироваться снизу вверх, антропогенные нарушения, такие как эвтрофикация и истощение популяции хищников, в последние десятилетия переместили эти системы под контроль сверху вниз (Бертнесс и Силлиман, 2008 г.) [18] .

Как нисходящие, так и восходящие силы были предложены в качестве основных факторов вымирания солончаков по всей западной Атлантике. Относительная важность этих факторов зависит от абиотических и биотических условий каждой локальной или региональной болотной системы и ее среды.
Человеческая деятельность может вызывать трофические каскады (Jefferies 1997), [20] которые возникают, когда хищники, ограничивающие численность добычи и тем самым повышающие выживаемость следующего более низкого трофического уровня, истощаются (Strong 1992). [4] Истощение высших хищников освобождает их добычу от контроля потребителей и приводит к снижению популяции следующего более низкого трофического уровня, часто первичных производителей . Трофические каскады возникают как минимум на трех трофических уровнях и могут влиять на динамику сообщества в различных системах (Estes et al. 1998). [28] Трофические каскады могут вызывать вымирание солончаков и превращать зеленые ландшафты в пустоши (Estes and Duggins 1995, Silliman et al. 2005). [10] [27] Основными причинами трофических каскадов, вызванных деятельностью человека, являются внедрение инвазивных видов , чрезмерная эксплуатация и изменение климата (Джексон и др. 2001, Лотце и др. 2006, Гедан и др. 2009, Гедан и Бертнесс 2011). [29] [30]

Введение человеком неместных видов также может способствовать контролю над болотными системами сверху вниз (Furbish and Albano 1994, Gough and Grace 1998). [24] [31] Завезенные дикие лошади на барьерные острова Мэриленда, Вирджинии и Каролины полностью оголили болотные экосистемы (Furbish and Albano 1994), [24] а завезенные грызуны нутрии на болота побережья Мексиканского залива в Луизиане могут снизить первичную продуктивность болотных растений (Gough and Grace 1998). [31]
Инвазивный зеленый краб, Carcinus maenas , может отключить контроль сверху вниз, способствуя восстановлению экосистем солончаков. В болотах, которые испытали вымирание через трофический каскад, инициированный любительским чрезмерным выловом рыбы, пурпурные болотные крабы, Sesarma reticulatum , могут быть вытеснены более крупными зелеными крабами, которые охотятся на пурпурного краба. Таким образом, зеленые крабы могут косвенно снизить травоядность пурпурного краба и способствовать восстановлению кордграсса. Эти результаты обнадеживают, поскольку они предполагают, что инвазивные виды, которые классически считаются оказывающими в основном негативное воздействие на экосистемы, в которые они вторгаются, иногда могут фактически способствовать восстановлению деградировавших экосистем. [32]
Гибель растений солончаков в некоторых районах может быть потенциально объяснена патогенами растений солончаков – виды грибов были выявлены в местах гибели растений в Великобритании, а также на атлантическом побережье США и побережье Мексиканского залива (Elmer 2013). [33] Деградация болот, вызванная грибами, является документально подтвержденной проблемой, особенно в Юго-Восточной Атлантике. Болотные улитки Littoraria irrorata делают небольшие надрезы в стренге во время выпаса скота. Эти надрезы способствуют росту грибка, а при высокой плотности улиток могут привести к массовым инфекциям , увеличению выпаса скота и последующей гибели (Silliman and Bertness 2002, Silliman and Newell 2003, Silliman et al. 2005). [22] [27] [34]
В прибрежной Новой Англии эти доказательства слабее. Определенные грибковые патогены S. alterniflora чаще обнаруживались в местах отмирания. Эти патогены имеют разную степень вирулентности , и есть некоторые доказательства связи с видами Fusarium и зонами отмирания. Однако, хотя эта связь предполагает частичную причинно-следственную связь, особенно в растениях, предрасположенных к стрессу, отсутствуют веские доказательства , позволяющие предположить, что такие грибковые патогены являются основной причиной отмирания в Новой Англии (Elmer 2013). [33]
Чрезмерный вылов привел к краху различных мелководных морских экосистем по всему миру (Джексон и др., 2001 г.), [29] включая коралловые рифы (Хьюз и др., 2003 г.), [35] водорослевые заросли и леса из водорослей (Эстес и др., 1998 г.) [28] .

Исследования солончаковой улитки Littoraria irrorata и ее влияния на продуктивность болотных растений предоставили убедительные доказательства контроля потребителей на болотах, вызванного чрезмерной эксплуатацией. Эта улитка способна превратить пряди спартины (Spartina alterniflora ) (>2,5 м высотой) в илистые отмели в течение 8 месяцев, что составляет менее одного вегетационного периода (Silliman and Bertness 2002). [22] Как уже упоминалось ранее, болотные улитки наносят порезы листьям спартины, когда пасутся, обеспечивая субстрат и питательные вещества для грибка . При высокой плотности улиток спартина может поддаться грибковым инфекциям , и может наступить вымирание болот (Silliman and Bertness 2002, Silliman and Newell 2003, Silliman et al. 2005). [22] [27] [34] Естественными хищниками болотной улитки являются синие крабы ( Callinectes sapidus ) и черепахи-террапины ( Malaclemys terrapin ), которые исторически регулировали численность улиток. Однако эти хищники подвергались коммерческой чрезмерной эксплуатации и теперь страдают от болезней из-за небольшого размера популяции, освобождая улиток от давления потребителей и позволяя улиткам сеять хаос в популяциях солончаковых трав (Silliman and Zieman 2001). [22] [26]

Классический пример трофического каскада был вызван чрезмерной эксплуатацией морских выдр в 1980-х годах (Estes & Duggins 1995). [10] Морские выдры едят морских ежей , которые, в свою очередь, питаются макроводорослями в пищевой цепи, которая при изменении может привести к появлению пустошей морских ежей . На морских выдр на Аляске охотились до почти полного исчезновения из-за их шкур . Там, где популяции морских выдр сохранились, они подавляют численность морских ежей и, таким образом, оказывают косвенное положительное влияние на плотность макроводорослей. Напротив, в местах, где морские выдры отсутствуют, популяции морских ежей резко возросли и привели к развитию пустошей морских ежей. Везде, где морские выдры были восстановлены, популяции морских ежей сократились, а плотность водорослей увеличилась, вернув среду обитания к ее первоначальному здоровому состоянию. Этот пример демонстрирует потенциал восстановления всей экосистемы с повторным созданием потребителей (Эстес и Даггинс, 1995). [10]
Другие трофические каскады, например, вызванные крабами, такими как Chasmagnathus granulata в Южной Америке, по крайней мере частично вызваны чрезмерным выловом высших хищников (Bortolus и Iribarne 1999, Alberti et al. 2007). [21] [25]

В Новой Англии истощение популяции хищников вызвало обширное вымирание болот и берегов ручьев на солончаках. Травоядность уже повлияла на 90% берегов ручьев в более чем 70% внешних болот Кейп-Кода. Отсутствовавшая в 1997 году, вымирание недавно распространилось на залив Наррагансетт , Род-Айленд, затронув более 85% берегов ручьев. Ночной пурпурный болотный краб Sesarma reticulatum играет важную роль в этом вымирании за счет увеличения рытья нор и травоядности из-за освобождения от давления хищников. Доказательства указывают на нисходящий контроль, вызванный вмешательством человека, как на основной фактор, вызывающий вымирание.
Альтиери и коллеги провели серию экспериментов (Altieri et al. 2012) [36] , направленных на выяснение механизмов, вызывающих вымирание болот, более конкретно. На крабов Sesarma обычно охотятся синие крабы ( Callinectes sapidus ) и рыбы , включая полосатого окуня ( Morone saxatilis ) и гладкую акулу ( Mustelus canis ). Хотя каскадные эффекты чрезмерного вылова были продемонстрированы в различных экосистемах (Myers and Worm 2003), исследования истощения популяции хищников были сосредоточены почти исключительно на влиянии крупномасштабного коммерческого чрезмерного вылова (Worm et al. 2009). Однако Альтиери и коллеги (2012) [36] продемонстрировали, что хищники Sesarma подвергались и продолжают подвергаться чрезмерной эксплуатации рыболовами-любителями . Результаты исследования показывают, что болота, где наблюдается отмирание, и болота, покрытые растительностью, существенно различаются по уровню любительского рыболовства, поскольку рыболовы наблюдались только в местах отмирания.
На болотах, где происходил вымирание, биомасса хищников высшего уровня была вдвое меньше, чем на участках с растительностью, в то время как биомасса невыловленных потребителей не отличалась между участками с вымиранием и участками с растительностью. Кроме того, уровень хищничества Sesarma на участках с растительностью был в три раза выше, чем на участках с вымиранием, а крабы потребляли в четыре раза больше травы на участках с вымиранием, чем на участках с растительностью. Исторические реконструкции показали, что в период с 1939 по 2005 год на участках с нынешней растительностью наблюдалась небольшая чистая потеря болот (<5%). Напротив, на болотах, где происходил вымирание, вымирание началось в середине 70-х годов с последовательно увеличивающейся потерей растительности до 2005 года, когда >20% общей площади болот было потеряно из-за вымирания, а >80% зоны сардины было лишено растительности. Это расхождение между вымирающими и заросшими болотами в потере растительности совпадает с периодом быстрого увеличения количества доков и лодочных спусков до середины 70-х годов, что привело к созданию >70% той рыболовной инфраструктуры , которая в настоящее время присутствует на вымирающих болотах. Эти результаты свидетельствуют о том, что освобождение Sesarma от давления хищников крабов и рыб из-за чрезмерного вылова рыбы рыболовами запускает трофический каскад, который отвечает за обширное вымирание болот по всей южной части Новой Англии (Altieri et al. 2012). [36]
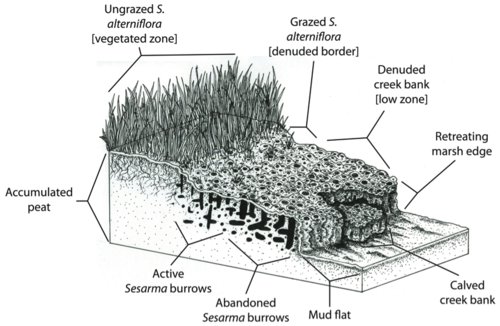
Альтиери и коллеги (2012) [36] далее выдвинули гипотезу о том, что историческая, крупномасштабная, промышленная чрезмерная эксплуатация рыбы в северо-западной части Атлантического океана (Лотце и др., 2006) [30] увеличила уязвимость болот к воздействию локального любительского рыболовства до такой степени, что последовало крупномасштабное вымирание, и что результирующее локальное вымирание может объединиться в полное региональное вымирание болот, если чрезмерная эксплуатация основных потребителей продолжится (Альтиери и др., 2012). [36]
Совсем недавно Бертнесс и коллеги (Bertness et al. 2014b) [37] провели полевой эксперимент, исключив хищников из участков на границе выпаса болота. В течение одного вегетационного периода исключение высших хищников вызвало вымирание за счет увеличения численности крабов Sesarma и интенсивности травоядности. Для дальнейшей проверки гипотезы трофического каскада Бертнесс и коллеги использовали распространение вымирания в заливе Наррагансетт, чтобы оценить все предполагаемые факторы вымирания, включая: 1) эвтрофикация снижает инвестиции растений в подземную биомассу, вызывая гибель растений, 2) кильватерные следы от лодок разрушают берега ручьев, 3) загрязнение или болезни влияют на здоровье растений, 4) твердость субстрата контролирует распределение травоядных крабов и 5) трофическая дисфункция освобождает Sesarma от контроля хищников. Доступность азота, интенсивность волн и рост растений не объясняют никаких изменений в вымирании. Однако травоядность объясняет более 70% межсайтовых различий в показателях вымирания. (Бертнесс и др., 2014а) [38] В этой работе был выделен один конкретный пример, в котором экспериментально показано, что нисходящие взаимодействия являются основным фактором изменения состояния экологического сообщества.
Одна из теорий контроля снизу вверх заключается в дифференциальной химии почвы между заросшими и отмирающими областями. Было предложено, что изменения в химии почвы, связанные с засухой, связаны с областями отмирания. Засухи часто связаны с повышенной соленостью и кислотностью — почвы окисляются при ограничении пресной воды или приливной влажности , что приводит к повышенной кислотности. Гиперсоленость связана с уменьшением выживаемости S. alterniflora (Brown et al. 2005). [39] Однако растения солончаков, как правило, устойчивы к широкому диапазону уровней солености, и повышенная соленость не всегда наблюдается в местах отмирания (Alber et al. 2008). [40]
Существует неопределенность, приписываемая связи между различными почвенными условиями и местами отмирания по нескольким причинам. Во-первых, измерения могут проводиться недостаточно часто, чтобы зафиксировать кратковременные колебания почвенных условий, связанные с отмиранием. Во-вторых, приписывание причинно-следственной связи изменению почвенных условий и отмиранию потенциально сомнительно. Обратная причинно-следственная связь является потенциальным объяснением; то есть различия в химии почвы могут быть результатом, а не фактором отмирания. Например, одно исследование отметило более высокие уровни солености в районах отмирания в некоторые месяцы, но это, возможно, было связано с измененной динамикой корней или испарения из-за отмирания (Marsh 2007).
Обогащение питательными веществами является всеобъемлющей глобальной угрозой как для морских, так и для наземных экосистем (Galloway et al. 2008, Verhoeven et al. 2006). [41] [42] В морских экосистемах увеличение потока азота может вызвать сильное цветение водорослей, бескислородные условия и широкомасштабные потери рыболовства (Diaz & Rosenberg 2008). [43] В солончаках, важной экосистеме интерфейса между сушей и морем, было высказано предположение, что добавление питательных веществ способствует широкомасштабному вымиранию ручьев (Deegan et al. 2012). [44]
Чтобы проверить эту гипотезу, Линда Диган и коллеги провели девятилетнее исследование на одном участке в Массачусетсе. Исследователи обнаружили, что обогащение приливного ручья азотом и фосфором привело к снижению инвестиций в подземные питательные корни и корневища, усилению микробного разложения органического вещества и, в конечном итоге, к разрушению ручья и потере солончака (Диган и др., 2012). [44]
Однако аналогичные исследования в Коннектикуте не смогли повторить эти результаты. Шимон Анисфельд и Трой Хилл провели 5-летний эксперимент по удобрению солончака в проливе Лонг-Айленд и обнаружили, что ни азотное, ни фосфорное удобрение не привело к потере высоты, снижению содержания углерода в почве или снижению первичной подземной продукции. Они предполагают, что высокие уровни питательных веществ могут значительно изменить процессы в болотах и увеличить валовую потерю углерода из отложений, но другие процессы могут компенсировать эти воздействия. В этом исследовании не ожидается никаких чистых пагубных эффектов нагрузки питательных веществ на хранение углерода или на стабильность болот (Анисфельд и Хилл 2012). [45]
Другие исследования эвтрофикации, проведенные в заливе Наррагансетт, Род-Айленд, показали, что экспериментальное добавление азота изначально увеличивает продуктивность растений, но в конечном итоге приводит к снижению биомассы растений из-за поедания травоядными насекомыми (Bertness et al. 2008). [46] Чтобы дополнить этот эксперимент, исследователи провели опросы на 20 солончаках, чтобы изучить взаимодействие между уровнями питательных веществ в болотах и давлением травоядных животных, и обнаружили, что поставка азота в болотах является хорошим предиктором повреждения растений травоядными. Это исследование предполагает, что эвтрофикация в настоящее время вызывает потребительское подавление первичной продуктивности в солончаках Новой Англии и в конечном итоге может представлять угрозу для предоставления услуг экосистемы солончаков (Bertness et al. 2008). [46]
Прибрежные экосистемы страдают от различных антропогенных воздействий , таких как крупномасштабная эвтрофикация , изменение пищевой цепи , неконтролируемые потребительские эффекты, изменение климата , разрушение среды обитания и болезни . Редко эти факторы действуют изолированно. Часто исследователи обнаруживают аддитивные или синергические взаимодействия между воздействиями, усугубляющими степень деградации экосистемы . Один из таких примеров можно найти в солончаках на юго-востоке США. Истощение высших хищников в этих системах привело к чрезмерному выпасу улиток на солончаковой траве и последующему вымиранию (как объяснялось выше). Однако это вымирание было связано с интенсивными засушливыми условиями и последующим увеличением солевого и кислотного стресса (Silliman et al. 2005). [27] Засушливый стресс, который повышает соленость почвы и увеличивает уязвимость травяной травы к контролю сверху вниз, может быть результатом изменения климата (Silliman and Bertness 2002, Silliman et al. 2005). [22] [27] Подобные случаи демонстрируют, как абиотические и биотические взаимодействия могут влиять на здоровье экосистемы .
Антропогенные действия также могут вызывать эвтрофикацию или увеличивать нагрузку питательных веществ на морские экосистемы через сток в систему, содержащую удобрения , сточные воды , средство для мытья посуды и другие вещества, богатые азотом и фосфором. Эвтрофикация широко распространена в прибрежных морских экосистемах (Lotze et al. 2006) [30] и может косвенно инициировать трофические каскады и усиливать контроль потребителей над растениями. Например, травоядность насекомых на болотах положительно коррелирует с доступностью питательных веществ в солончаках Атлантики (Bertness et al. 2008). [46] В заливе Наррагансетт травоядность насекомых подавляет первичную продукцию нарушенных человеком солончаков почти на 40%. Добавление азота в результате деятельности человека может увеличить травоядность насекомых настолько, что первичная продукция подавляется почти на 60%, в то время как болота без развития береговой линии человеком остаются исключительно под контролем снизу вверх (Bertness et al. 2008). [46] Увеличение поступления питательных веществ может привести к неконтролируемому росту травоядности и в других системах (Гоф и Грейс, 1998 г., Силлиман и Зиман, 2001 г.). [26] [31]
Например, эвтрофикация инициирует контроль сверху вниз через воздействие белых гусей на арктические болота Гудзонова залива (Jefferies 1997). [20] К 1980-м годам белые гуси, которые изначально ежегодно мигрировали в Гудзонов залив, перешли от кормления в умеренных водно-болотных угодьях к кормлению на сильно удобренных сельскохозяйственных полях. За 30 лет популяция гусей резко возросла. С тех пор белые гуси полностью уничтожили сотни тысяч акров водно-болотных угодий Гудзонова залива. Гуси выкапывали корни болотных растений, испарение увеличивалось, что приводило к последующему повышению солености, и без растений, насыщающих почву кислородом, субстрат стал бескислородным. Эта нежелательная среда для болотных растений препятствует половому рекрутированию в этом районе. Белые гуси оголили болото, пока повторное заселение клонированными бегунами не восстановит болотную растительность, что может занять годы. Из-за использования искусственных удобрений на сельскохозяйственных полях умеренной зоны был инициирован трофический каскад (Jefferies 1997). [20]
Основной целью экологии в следующем столетии станет понимание того, как экосистемы будут реагировать на текущее и будущее воздействие человека, а также на аддитивные или синергические взаимодействия между ними.

Экосистемные услуги — это выгоды, которые люди получают от экологических систем. Сегодня одним из аргументов в пользу защиты солончаков является повышение качества и количества этих услуг. Солончаки изолируют азот, фильтруя сточные воды и сокращая поступление азота в эстуарии (Valiela and Cole 2002). [47] Солончаки также обеспечивают необходимую среду обитания для молодых рыб и ракообразных , обеспечивая прибрежное рыболовство (Boesch and Turner 1984) [48] , на долю которого приходится 90% мирового улова рыбы (UNEP 2006). [49] Солончаки также изолируют углерод , что станет важной экосистемной услугой по мере усиления изменения климата (Chmura et al. 2003). [50] Вероятно, наиболее важной экосистемной услугой солончаков является их способность действовать как естественные морские барьеры, поскольку травы связывают почвы, предотвращают эрозию береговой линии , смягчают волны и уменьшают прибрежные наводнения (Costanza et al. 2008). [51]
Однако естественная способность болота противостоять эрозии и наводнениям может быть снижена из-за отмирания берегов ручьев. Поскольку Spartina alterniflora отвечает за связывание осадков и отложение торфа (Redfield 1965), [52] отмирание кордграсса может поставить под угрозу способность солончаков идти в ногу с повышением уровня моря . Кроме того, концентрация нор Sesarma в торфе солончаков Новой Англии может напрямую спровоцировать эрозию и разрушение торфяного основания болот.
На Кейп-Коде берега болотных ручьев часто настолько пронизаны норами Sesarma , что они разрушаются, обнажая свежий торф для дальнейшего закапывания и эрозии (Bertness et al. 2008). [46] Обратные связи между травоядностью крабов и вымиранием стренграсса могут, таким образом, привести к отступлению краев болот. Например, Ковердейл и коллеги обнаружили, что 20 лет вымирания на Кейп-Коде привели к потере более 200 лет наращивания болот и потере сотен акров болот. [53] Пагубное воздействие трофических каскадов на болота не только снижает биоразнообразие , здоровье и эстетическую привлекательность этих экосистем, но и ставит под угрозу способность болот предоставлять ключевые экосистемные услуги человеческому населению.
Несмотря на растущее количество доказательств обратного, контроль снизу вверх остается центральной догмой, определяющей управление болотами , усилия по сохранению и восстановлению . В настоящее время солончаки управляются так, как будто они регулируются исключительно физическими факторами. Однако глобальное и прибрежное истощение популяции хищников, приводящее к высвобождению скрытных или недооцененных травоядных, может быть самой большой текущей угрозой для солончаков. Зависимость от теории (подсознательное предпочтение идентификации и/или изучению природных явлений, которые, как правило, подтверждают, а не опровергают текущую парадигму системы изучения [Kuhn 1962] [54] ) и демонстрация, а не фальсификация науки, были основными виновниками этого упущения. Следовательно, угрозы солончакам, которые регулируются контролем сверху вниз, игнорируются, что может иметь потенциально разрушительные последствия.
Трофические каскады — это мощные взаимодействия, которые строго регулируют биоразнообразие , структуру сообщества и функцию экосистемы. Первоначально считалось, что трофические каскады редки, но стало ясно, что они встречаются в различных наземных, пресноводных и морских экосистемах как в малых, так и в больших пространственных и временных масштабах. Трофические каскады — это обычные и всепроникающие аспекты многих сообществ, которые долгое время считались контролируемыми силами снизу вверх и/или устойчивыми к контролю со стороны потребителей.
Таким образом, сохранение экосистем, затронутых трофическими каскадами, не включило должным образом контроль сверху вниз в свои планы и усилия по управлению и восстановлению, но новые исследования подчеркивают, что это необходимо для защиты услуг, предоставляемых этими экосистемами, и для восстановления этих экосистем до их первоначальных условий. Невыполнение этого требования может привести к тому, что трофические каскады преобразуют весьма разнообразные и продуктивные растительные сообщества в бесплодные равнины.
Кроме того, неспособность пересмотреть существующую парадигму и признать, что как восходящие, так и нисходящие силы влияют на многие характеристики структуры и функционирования экосистемы и что эти силы являются взаимодополняющими, а не противоречащими друг другу, может помешать включению обоих механизмов в любой план управления и снизить успешность усилий по сохранению еще до их начала.