Генотоксичность — это свойство химических агентов, которые повреждают генетическую информацию внутри клетки, вызывая мутации , которые могут привести к раку . Хотя генотоксичность часто путают с мутагенностью , все мутагены генотоксичны, но некоторые генотоксичные вещества не являются мутагенными. Изменение может иметь прямые или косвенные эффекты на ДНК: индукция мутаций, несвоевременная активация событий и прямое повреждение ДНК, приводящее к мутациям. Постоянные, наследуемые изменения могут влиять как на соматические клетки организма, так и на зародышевые клетки, которые передаются будущим поколениям. [1] Клетки предотвращают экспрессию генотоксичной мутации либо путем репарации ДНК , либо путем апоптоза ; однако повреждение не всегда может быть исправлено, что приводит к мутагенезу .
Для анализа генотоксичных молекул исследователи проводят анализ на наличие повреждений ДНК в клетках, подвергшихся воздействию токсичных субстратов. Это повреждение ДНК может быть в форме одно- и двухцепочечных разрывов, потери эксцизионной репарации, сшивания, щелочелабильных участков, точечных мутаций и структурных и числовых хромосомных аберраций. [2] Известно, что нарушение целостности генетического материала вызывает рак. В результате было разработано множество сложных методов, включая анализ Эймса, токсикологические тесты in vitro и in vivo и анализ комет, для оценки способности химических веществ вызывать повреждения ДНК, которые могут привести к раку.

Генотоксичные вещества вызывают повреждение генетического материала в клетках посредством взаимодействия с последовательностью и структурой ДНК. Например, переходный металл хром взаимодействует с ДНК в его высоковалентной степени окисления, вызывая повреждения ДНК, которые приводят к канцерогенезу . Метастабильная степень окисления Cr(V) достигается посредством восстановительной активации. Исследователи провели эксперимент по изучению взаимодействия ДНК с канцерогенным хромом, используя комплекс Cr(V)-Salen в определенной степени окисления. [3] Взаимодействие было специфичным для нуклеотида гуанина в генетической последовательности. Чтобы сузить взаимодействие между комплексом Cr(V)-Salen с основанием гуанина, исследователи модифицировали основания до 8-oxo-G, чтобы получить сайт-специфическое окисление. Реакция между двумя молекулами вызвала повреждения ДНК; два повреждения, обнаруженные в модифицированном участке основания, были гуанидиногидантоином и спироиминодигидантоином. Для дальнейшего анализа места поражения было отмечено, что полимераза остановилась на этом месте, а аденин был неправильно включен в последовательность ДНК напротив основания 8-oxo-G. Таким образом, эти поражения преимущественно содержат трансверсии G→T . Высоковалентный хром, как полагают, действует как канцероген, поскольку исследователи обнаружили, что «механизм повреждения и продукты окисления оснований для взаимодействия между высоковалентным хромом и ДНК... имеют отношение к in vivo образованию повреждения ДНК, приводящего к раку в популяциях людей, подвергшихся воздействию хромата». [3] Следовательно, это показывает, как высоковалентный хром может действовать как канцероген с 8-oxo-G, образуя ксенобиотики . [3]
Другим примером генотоксичного вещества, вызывающего повреждение ДНК, являются пирролизидиновые алкалоиды (ПА). Эти вещества встречаются в основном в растениях и ядовиты для животных, включая людей; около половины из них были идентифицированы как генотоксичные, а многие как онкогенные. Исследователи пришли к выводу из тестирования, что при метаболической активации «ПА производят ДНК-аддукты, сшивание ДНК, разрывы ДНК, обмен сестринскими хроматидами, микроядра, хромосомные аберрации, генные мутации и хромосомные мутации in vivo и in vitro ». [4] Наиболее распространенными мутациями в генах являются трансверсии G:C → T:A и тандемная замена оснований. Пирролизидиновые алкалоиды мутагены in vivo и in vitro и, следовательно, ответственны за канцерогенез, особенно в печени. [4] Окопник является примером вида растения, который содержит четырнадцать различных ПА. Активные метаболиты взаимодействуют с ДНК, вызывая повреждение ДНК, индукцию мутаций и развитие рака в эндотелиальных клетках печени и гепатоцитах . В конце концов исследователи обнаружили, что «окопник мутагенен в печени, а содержащиеся в окопнике ПА, по-видимому, ответственны за токсичность, вызванную окопником, и индукцию опухолей». [5]
Целью испытаний на генотоксичность является определение того, повлияет ли субстрат на генетический материал или может ли он вызвать рак. Они могут проводиться на клетках бактерий, дрожжей и млекопитающих. [2] С помощью знаний, полученных в ходе испытаний, можно контролировать раннее развитие организмов, уязвимых к генотоксичным веществам. [1]
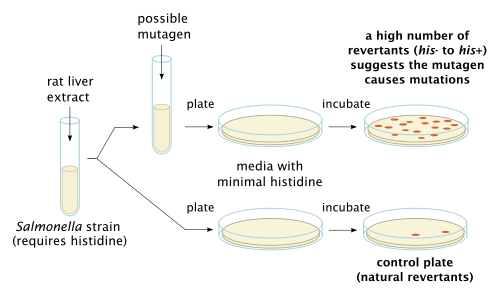
Бактериальный анализ обратной мутации, также известный как анализ Эймса , используется в лабораториях для проверки на мутацию генов. Метод использует множество различных штаммов бактерий для сравнения различных изменений в генетическом материале. Результат теста обнаруживает большинство генотоксичных канцерогенов и генетических изменений; типы обнаруженных мутаций - сдвиги рамки и замены оснований. [6]
Целью тестирования in vitro является определение того, вызывает ли субстрат, продукт или фактор окружающей среды генетические повреждения. Один из методов подразумевает цитогенетические анализы с использованием различных клеток млекопитающих. [6] Типы аберраций , обнаруженных в клетках, пораженных генотоксическим веществом, включают хроматидные и хромосомные разрывы, разрывы хромосом, хроматидные делеции, фрагментацию, транслокацию, сложные перестройки и многое другое. Кластогенные или анеугенные эффекты от генотоксического повреждения приведут к увеличению частоты структурных или числовых аберраций генетического материала. [6] Это похоже на микроядерный тест и анализ хромосомных аберраций, которые обнаруживают структурные и числовые хромосомные аберрации в клетках млекопитающих. [1]
В определенной ткани млекопитающего можно провести анализ лимфомы мыши TK+/- для проверки изменений в генетическом материале. [6] Генные мутации обычно являются точечными мутациями, изменяющими только одно основание в генетической последовательности для изменения последующего транскрипта и аминокислотной последовательности; эти точечные мутации включают замены оснований, делеции, сдвиги рамки и перестройки. Кроме того, целостность хромосом может быть изменена из-за потери хромосом и кластогенных поражений, вызывающих множественные генные и мультилокусные делеции. Конкретный тип повреждения определяется размером колоний, различая генетические мутации (мутагены) и хромосомные аберрации (кластогены). [6]
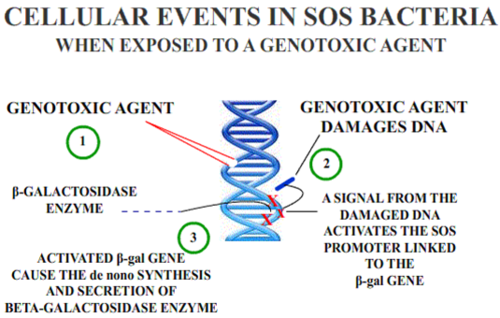
Тест SOS/umu assay оценивает способность вещества вызывать повреждение ДНК; он основан на изменениях в индукции ответа SOS из-за повреждения ДНК. Преимущества этого метода в том, что он быстрый и простой и удобен для множества веществ. Эти методы применяются к воде и сточным водам в окружающей среде. [7]
Целью тестирования in vivo является определение потенциала повреждения ДНК, которое может повлиять на структуру хромосом или нарушить митотический аппарат , который изменяет число хромосом; факторами, которые могут повлиять на генотоксичность, являются ADME и репарация ДНК. Он также может обнаружить генотоксичные агенты, пропущенные в тестах in vitro . Положительным результатом индуцированного повреждения хромосом является увеличение частоты микроядерных PCE. [6] Микроядро — это небольшая структура, отделенная от ядра, содержащая ядерную ДНК, возникшую из фрагментов ДНК или целых хромосом, которые не были включены в дочернюю клетку во время митоза. Причинами этой структуры являются митотическая потеря ацентрических хромосомных фрагментов (кластогенность), механические проблемы из-за разрыва и обмена хромосом, митотическая потеря хромосом (анеугенность) и апоптоз. Тест на микроядра in vivo похож на тест in vitro , поскольку он проверяет структурные и числовые хромосомные аберрации в клетках млекопитающих, особенно в клетках крови крыс. [6]
Анализ комет является одним из наиболее распространенных тестов на генотоксичность. Метод включает в себя лизирование клеток с использованием детергентов и солей. ДНК, высвобождаемая из лизированной клетки, подвергается электрофорезу в агарозном геле в условиях нейтрального pH. Клетки, содержащие ДНК с повышенным количеством двухцепочечных разрывов, будут быстрее мигрировать к аноду. Этот метод выгоден тем, что он обнаруживает низкие уровни повреждения ДНК, требует лишь очень небольшого количества клеток, дешевле многих методов, прост в исполнении и быстро отображает результаты. Однако он не определяет механизм, лежащий в основе генотоксического эффекта, или точный химический или химический компонент, вызывающий разрывы. [8]
Генотоксические эффекты, такие как делеции, разрывы и/или перестройки, могут привести к раку, если повреждение не приводит к немедленной гибели клетки. Регионы, чувствительные к разрыву, называемые хрупкими участками , могут быть результатом генотоксических агентов (таких как пестициды). Некоторые химические вещества обладают способностью индуцировать хрупкие участки в регионах хромосомы, где присутствуют онкогены , что может привести к канцерогенным эффектам. В соответствии с этим выводом, профессиональное воздействие некоторых смесей пестицидов положительно коррелирует с увеличением генотоксического повреждения у подвергшихся воздействию людей. Повреждение ДНК не одинаково по своей тяжести в разных популяциях, поскольку люди различаются по своей способности активировать или детоксифицировать генотоксичные вещества, что приводит к изменчивости заболеваемости раком среди людей. Различия в способности детоксифицировать определенные соединения обусловлены унаследованными полиморфизмами генов, участвующих в метаболизме химиката. Различия также могут быть связаны с индивидуальными различиями в эффективности механизмов восстановления ДНК [9]
Метаболизм некоторых химических веществ приводит к образованию активных форм кислорода (ROS), что является возможным механизмом генотоксичности. Это наблюдается в метаболизме мышьяка , который производит гидроксильные радикалы , которые, как известно, вызывают генотоксичные эффекты. [10] Аналогичным образом, ROS были вовлечены в генотоксичность, вызванную частицами и волокнами. Генотоксичность неволокнистых и волокнистых частиц характеризуется высокой продукцией ROS из воспалительных клеток . [11]
Выявлены основные генотоксические агенты, ответственные за четыре наиболее распространенных вида рака в мире (рак легких, молочной железы, толстой кишки и желудка).
Рак легких является наиболее распространенным видом рака в мире, как с точки зрения ежегодных случаев (1,61 миллиона случаев; 12,7% всех случаев рака), так и с точки зрения смертности (1,38 миллиона смертей; 18,2% всех случаев смерти от рака). [12] Табачный дым является основной причиной рака легких. Оценки риска рака легких показывают, что табачный дым является причиной 90% случаев рака легких в Соединенных Штатах. Табачный дым содержит более 5300 идентифицированных химических веществ. Наиболее значимые канцерогены в табачном дыме были определены с помощью подхода «предела воздействия». [13] Согласно этому подходу, опухолеобразующие соединения в табачном дыме были, в порядке важности, акролеин , формальдегид , акрилонитрил , 1,3-бутадиен , кадмий , ацетальдегид , этиленоксид и изопрен . В целом, эти соединения являются генотоксичными и вызывают повреждение ДНК. В качестве примеров сообщалось о повреждающем эффекте на ДНК для акролеина [14] , формальдегида [15] и акрилонитрила. [16]
Рак молочной железы является вторым по частоте раком в мире в годовом исчислении [(1,38 миллиона случаев, 10,9% всех случаев рака), и занимает 5-е место как причина смерти (458 000, 6,1% всех случаев смерти от рака)]. [12] Риск рака молочной железы связан с постоянно высоким уровнем эстрогена в крови . [17] Эстроген, вероятно, способствует канцерогенезу молочной железы посредством следующих трех процессов: (1) метаболическое превращение эстрогена в генотоксичные, мутагенные канцерогены, (2) стимуляция роста тканей и (3) подавление ферментов детоксикации фазы II , которые метаболизируют генотоксичные активные формы кислорода , тем самым приводя к повышенному окислительному повреждению ДНК. [18] [19] [20] Основной человеческий эстроген, эстрадиол , может метаболизироваться в производные хинона , которые образуют аддукты ДНК . [21] Эти производные могут вызывать удаление оснований из фосфодиэфирного остова ДНК (например, депуринизацию ). Это удаление может сопровождаться неточным восстановлением или репликацией апуринового сайта, что приводит к мутации и в конечном итоге к раку.
Колоректальный рак является третьим по частоте раком в мире [1,23 миллиона случаев (9,7% всех случаев рака), 608 000 смертей (8,0% всех случаев смерти от рака)]. [12] В Соединенных Штатах табачный дым может быть причиной до 20% случаев колоректального рака. [22] Кроме того, имеются существенные доказательства того, что желчные кислоты являются важным генотоксическим фактором при раке толстой кишки. [23] В частности, желчная кислота дезоксихолевая кислота вызывает выработку активных форм кислорода, повреждающих ДНК, в эпителиальных клетках толстой кишки человека и грызунов. [23]
Рак желудка является четвертым по распространенности видом рака в мире [990 000 случаев (7,8% всех случаев рака), 738 000 смертей (9,7% всех случаев смерти от рака)]. [12] Инфекция Helicobacter pylori является основным причинным фактором рака желудка. Хроническое воспаление, вызванное H. pylori , если его не лечить, часто является длительным. Инфекция H. pylori эпителиальных клеток желудка вызывает повышенную выработку генотоксичных активных форм кислорода (ROS). [24] [25] ROS вызывают окислительное повреждение ДНК, которое включает в себя основное изменение основания 8-оксо-2'-дезоксигуанозина . В недавнем ретроспективном исследовании было обнаружено, что использование секвестранта желчных кислот было связано со значительным снижением риска рака желудка, что позволяет предположить, что желчные кислоты могут быть фактором, способствующим развитию рака желудка. [26]
Генотоксическая химиотерапия — это лечение рака с использованием одного или нескольких генотоксических препаратов. Лечение традиционно является частью стандартизированного режима . Используя деструктивные свойства генотоксинов, лечение направлено на то, чтобы вызвать повреждение ДНК в раковых клетках. Любое повреждение, нанесенное раку, передается потомкам раковых клеток по мере продолжения пролиферации . Если это повреждение достаточно серьезное, оно заставит клетки подвергнуться апоптозу . [27]
Недостатком лечения является то, что многие генотоксичные препараты одинаково эффективны как для раковых клеток, так и для нормальных клеток. Избирательность действия конкретного препарата основана на чувствительности самих клеток. Таким образом, хотя быстро делящиеся раковые клетки особенно чувствительны ко многим видам лечения, часто страдают и нормальные функционирующие клетки. [27]
Другой риск лечения заключается в том, что, помимо генотоксичности, многие из препаратов также являются мутагенными и цитотоксичными . Таким образом, действие этих препаратов не ограничивается только повреждением ДНК. Кроме того, некоторые из этих препаратов, предназначенных для лечения рака, сами по себе являются канцерогенами , что повышает риск возникновения вторичных видов рака, таких как лейкемия . [27]
В этой таблице представлены различные методы лечения рака, основанные на генотоксичности, а также примеры. [27]
Генотоксическое повреждение ДНК в почках было связано как с острым, так и с хроническим повреждением почек , а также с почечноклеточной карциномой . [28] Исследования людей с генетическими недостатками в путях восстановления ДНК показали, что их почки особенно уязвимы к повреждениям ДНК, таким как сшивки ДНК, разрывы ДНК и повреждения, блокирующие транскрипцию. [28]