
Декарбоксилирование — это химическая реакция , которая удаляет карбоксильную группу и выделяет углекислый газ (CO 2 ). Обычно декарбоксилирование относится к реакции карбоновых кислот , удаляющей атом углерода из углеродной цепи. Обратный процесс, который является первым химическим шагом в фотосинтезе , называется карбоксилированием , присоединением CO 2 к соединению. Ферменты, катализирующие декарбоксилирование, называются декарбоксилазами или, более формальным термином, карбокси-лиазами ( номер EC 4.1.1).
Термин «декарбоксилирование» обычно означает замену карбоксильной группы ( −C(O)OH ) атомом водорода :
Декарбоксилирование — одна из старейших известных органических реакций. Это один из процессов, предположительно сопровождающих пиролиз и деструктивную дистилляцию .
В целом декарбоксилирование зависит от стабильности карбаниона синтона R−
, [1] [2] хотя анион может не быть настоящим химическим промежуточным соединением . [3] [4] Обычно карбоновые кислоты декарбоксилируются медленно, но карбоновые кислоты с α -электроноакцепторной группой (например, β- кетокислоты , β-нитрилы, α- нитрокислоты или арилкарбоновые кислоты ) декарбоксилируются легко. Декарбоксилирование хлордифторацетата натрия приводит к образованию дифторкарбена :
Декарбоксилирования играют важную роль в синтезе малонового и ацетоуксусного эфиров . Конденсация Кневенагеля и они позволяют кетокислотам служить стабилизирующей защитной группой для енолов карбоновых кислот . [6] [ нужна страница ] [4]
Для свободных кислот условия, которые депротонируют карбоксильную группу (возможно, протонируют электроноакцепторную группу с образованием цвиттер-ионного таутомера ), ускоряют декарбоксилирование. [7] Сильное основание является ключом к кетонизации , при которой пара карбоновых кислот объединяется с одноименной функциональной группой : [8] [3]
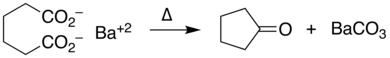
Соли переходных металлов , особенно соединения меди , [9] облегчают декарбоксилирование через промежуточные карбоксилатные комплексы . Металлы, катализирующие реакции кросс-сочетания , таким образом, рассматривают арилкарбоксилаты как синтон арильного аниона; эта синтетическая стратегия является реакцией декарбоксилирующего кросс-сочетания . [10]
При нагревании в циклогексаноне аминокислоты декарбоксилируются. В родственной реакции Хаммика некатализируемое декарбоксилирование пиколиновой кислоты дает стабильный карбен , который атакует карбонильный электрофил.
Окислительные декарбоксилирования — это, как правило, радикальные реакции. К ним относятся электролиз Кольбе и реакции Хунсдикера — Кочи . Декарбоксилирование Бартона — необычное радикальное восстановительное декарбоксилирование.
Как описано выше, большинство декарбоксилирований начинаются с карбоновой кислоты или ее соли щелочного металла, но декарбоксилирование Крапчо начинается с метиловых эфиров . В этом случае реакция начинается с расщепления эфира, опосредованного галогенидом , с образованием карбоксилата.
Декарбоксилирования широко распространены в биологии. Их часто классифицируют в соответствии с кофакторами, катализирующими превращения. [11] Биотин -сопряженные процессы осуществляют декарбоксилирование малонил-КоА в ацетил-КоА . Тиамин (T:) является активным компонентом для декарбоксилирования альфа-кетокислот , включая пируват:
Пиридоксальфосфат способствует декарбоксилированию аминокислот. Флавин -зависимые декарбоксилазы участвуют в превращениях цистеина. Гидроксилазы на основе железа действуют путем восстановительной активации O 2, используя декарбоксилирование альфа-кетоглутарата в качестве донора электронов. Декарбоксилирование можно изобразить следующим образом:
Распространенными биосинтетическими окислительными декарбоксилированиями аминокислот в амины являются :
Другие реакции декарбоксилирования из цикла лимонной кислоты включают:

Синтез жирных кислот с прямой цепью происходит путем повторяющихся реакций, включающих декарбоксилирование малонил-КоА . [12]

При нагревании Δ9-тетрагидроканнабиноловая кислота декарбоксилируется, давая психоактивное соединение Δ9- тетрагидроканнабинол . [13] Когда каннабис нагревается в вакууме, декарбоксилирование тетрагидроканнабиноловой кислоты (ТГКК), по-видимому, следует кинетике первого порядка . Логарифмическая доля присутствующей ТГКК неуклонно уменьшается с течением времени, а скорость уменьшения варьируется в зависимости от температуры. При увеличении температуры на 10 градусов от 100 до 140 °C половина ТГКК потребляется за 30, 11, 6, 3 и 2 минуты; следовательно, константа скорости следует закону Аррениуса , варьируясь от 10−8 до 10−5 в линейной логарифмической зависимости от обратной температуры. Однако моделирование декарбоксилирования салициловой кислоты с молекулой воды предположило активационный барьер в 150 кДж/моль для одной молекулы в растворителе, что слишком высоко для наблюдаемой скорости. Поэтому был сделан вывод, что эта реакция, проводимая в твердой фазе в растительном материале с высокой долей карбоновых кислот, следует кинетике псевдопервого порядка, в которой соседняя карбоновая кислота осаждается, не влияя на наблюдаемую константу скорости. Возможны два переходных состояния, соответствующие непрямому и прямому кето-енольным путям, с энергиями 93 и 104 кДж/моль. Оба промежуточных продукта включают протонирование альфа- углерода , разрывая одну из двойных связей ароматического кольца и позволяя бета-кетогруппе (которая принимает форму енола в ТГКК и ТГК) участвовать в декарбоксилировании. [14]
В напитках, хранящихся в течение длительного времени, очень небольшое количество бензола может образовываться из бензойной кислоты путем декарбоксилирования, катализируемого присутствием аскорбиновой кислоты . [15]
Сообщалось, что добавление каталитических количеств циклогексенона катализирует декарбоксилирование аминокислот . [16] Однако использование таких катализаторов может также приводить к образованию нежелательных побочных продуктов.