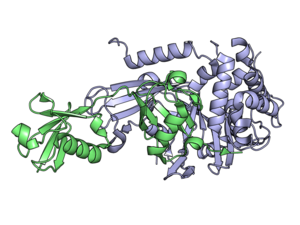

Деубиквитинирующие ферменты ( DUB ), также известные как деубиквитинирующие пептидазы , деубиквитинирующие изопептидазы , деубиквитиназы , убиквитиновые протеазы , убиквитингидролазы или убиквитинизопептидазы , представляют собой большую группу протеаз [1] , которые отщепляют убиквитин от белков. [2] Убиквитин присоединяется к белкам для регулирования деградации белков через протеасому и лизосому ; координирует клеточную локализацию белков; активирует и инактивирует белки; и модулирует белок-белковые взаимодействия . [3] [4] [5] DUB могут обращать эти эффекты, расщепляя пептидную или изопептидную связь между убиквитином и его субстратным белком. У людей существует около 100 генов DUB, которые можно разделить на два основных класса: цистеиновые протеазы и металлопротеазы . Цистеиновые протеазы включают убиквитин-специфические протеазы (USP), убиквитиновые С-концевые гидролазы (UCH), протеазы домена Мачадо-Джозефина (MJD) и протеазы опухолей яичников (OTU). Группа металлопротеаз содержит только протеазы домена Jab1/Mov34/Mpr1 Pad1 N-terminal+ (MPN+) (JAMM). [2]
У людей существует 102 предполагаемых гена DUB, которые можно разделить на два основных класса: цистеиновые протеазы и металлопротеазы , состоящие из 58 убиквитин-специфических протеаз (USP), 4 убиквитиновых С-концевых гидролаз (UCH), 5 протеаз домена Мачадо-Джозефина (MJD), 14 протеаз опухолей яичников (OTU) и 14 генов, содержащих домен Jab1/Mov34/Mpr1 Pad1 N-терминал+ (MPN+) (JAMM). Предполагается, что 11 из этих белков нефункциональны, в результате чего остается 79 функциональных ферментов. [6] У дрожжей USP известны как убиквитин-специфические протеазы процессинга (UBP).
Существует шесть основных суперсемейств цистеиновых протеаз DUB: [7]
Существует также малоизвестная предполагаемая группа DUB, называемая суперсемейством пермутированных папаиновых фолд-пептидаз вирусов и эукариот (PPPDE), которые, если будет доказано, что они являются настоящими DUB, будут седьмыми в классе цистеиновых протеаз. [11]
Белки суперсемейства доменов Jab1/Mov34/Mpr1 Pad1 N-terminal+ (MPN+) (JAMM) связывают цинк и, следовательно, являются металлопротеазами. [7]
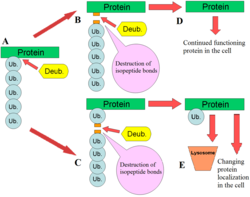
DUB играют несколько ролей в пути убиквитина. Одной из наиболее охарактеризованных функций DUB является удаление моноубиквитиновых и полиубиквитиновых цепей из белков. Эти модификации являются посттрансляционной модификацией (добавлением к белку после того, как он был создан), где отдельные убиквитиновые белки или цепи убиквитина добавляются к лизинам субстратного белка. Эти модификации убиквитина добавляются к белкам с помощью аппарата убиквитинирования; убиквитин-активирующих ферментов (E1), убиквитин-конъюгирующих ферментов (E2) и убиквитинлигаз (E3). Результатом является связывание убиквитина с остатками лизина через изопептидную связь . [12] Эти модификации влияют на белки несколькими способами: они регулируют деградацию белков через протеасому и лизосому ; координируют клеточную локализацию белков; активируют и инактивируют белки; и модулируют белок-белковые взаимодействия . [3] [4] [5] DUB играют антагонистическую роль в этой оси, удаляя эти модификации, тем самым обращая судьбу белков. [2] Кроме того, менее изученной ролью DUB является расщепление убиквитин-подобных белков, таких как SUMO и NEDD8 . Некоторые DUB могут обладать способностью расщеплять изопептидные связи между этими белками и субстратными белками. [13]
Они активируют убиквитин путем протеолиза (расщепления) неактивных экспрессированных форм убиквитина. Убиквитин кодируется у млекопитающих 4 различными генами: UBA52 , RPS27A , UBB и UBC . Похожий набор генов обнаружен у других эукариот, таких как дрожжи. Гены UBA52 и RPS27A производят убиквитин, который сливается с рибосомальными белками, а гены UBB и UBC производят полиубиквитин (цепь убиквитина, соединенную своими C- и N-концами ). [14] [15] DUB расщепляют убиквитин из этих белков, производя активные отдельные единицы убиквитина. [2]
DUB также расщепляют отдельные белки убиквитина, которые могли иметь свои C-концевые хвосты, случайно связанные с небольшими клеточными нуклеофилами . [2] Эти убиквитин- амиды и убиквитин- тиоэфиры могут быть образованы во время стандартных реакций убиквитинирования каскадом E1-E2-E3. Глутатион и полиамины являются двумя нуклеофилами, которые могут атаковать тиолэфирную связь между убиквитином и этими ферментами. Гидролаза C-конца убиквитина является примером DUB, который гидролизует эти связи с широкой специфичностью. [13] [16]
Свободные полиубиквитиновые цепи расщепляются DUB для получения моноубиквитина. Цепи могут быть получены механизмом E1-E2-E3 в клетке, свободной от любого субстратного белка. Другим источником свободного полиубиквитина является продукт расщепления убиквитин-субстрата. Если DUB расщепляют основание полиубиквитиновой цепи, прикрепленное к белку, вся цепь станет свободной и должна быть переработана DUB. [2]

DUB часто содержат каталитический домен, окруженный одним или несколькими вспомогательными доменами, некоторые из которых способствуют распознаванию цели. Эти дополнительные домены включают домен, присутствующий в домене убиквитин-специфических протеаз (DUSP); домен убиквитин-подобный (UBL); домен гомологии меприна и TRAF (MATH); домен цинк-пальцевой убиквитин-специфической протеазы (ZnF-UBP); домен цинк-пальцевой миелоидной, нервной и DEAF1 (ZnF-MYND); домен убиквитин-ассоциированный (UBA); домен CHORD-SGT1 (CS); домен взаимодействия с микротрубочками и трафика (MIT); домен роданазоподобный; домен TBC/RABGAP; и домен B-box. [6] [17]
Каталитический домен DUB классифицирует их на определенные группы: USP, OTU, MJD, UCH и MPN+/JAMM. Первые 4 группы представляют собой цистеиновые протеазы , тогда как последняя представляет собой цинковую металлопротеазу . Цистеиновые протеазы DUB подобны папаину и, таким образом, имеют схожий механизм действия. Они используют либо каталитические диады, либо триады (либо две, либо три аминокислоты ) для катализа гидролиза амидных связей между убиквитином и субстратом. Остатки активного центра, которые способствуют каталитической активности цистеиновых протеаз DUB, представляют собой цистеин (диада/триада), гистидин (диада/триада) и аспартат или аспарагин (только триада). Гистидин поляризуется аспартатом или аспарагином в каталитических триадах или другими способами в диадах. Этот поляризованный остаток снижает pKa цистеина, позволяя ему осуществлять нуклеофильную атаку на изопептидную связь между С-концом убиквитина и субстратом лизином . Металлопротеазы координируют ионы цинка с остатками гистидина, аспартата и серина , которые активируют молекулы воды и позволяют им атаковать изопептидную связь. [18] [19]
Убиквитин-подобные (UBL) домены имеют структуру (складку), похожую на убиквитин, за исключением отсутствия терминальных остатков глицина. Предполагается, что 18 USP имеют домены UBL. Только 2 других DUB имеют UBL вне группы USP: OTU1 и VCPIP1 . USP4, USP7, USP11, USP15, USP32, USP40 и USP47 имеют несколько доменов UBL. Иногда домены UBL находятся в тандеме, например, в USP7, где присутствуют 5 тандемных C-концевых доменов UBL. USP4, USP6, USP11, USP15, USP19, USP31, USP32 и USP43 имеют домены UBL, вставленные в каталитический домен. Функции доменов UBL различаются между USP, но обычно они регулируют каталитическую активность USP. Они могут координировать локализацию в протеасоме (USP14); негативно регулировать USP, конкурируя за каталитический сайт USP (USP4), и вызывать конформационные изменения для увеличения каталитической активности (USP7). [17] [20] [21] Как и другие домены UBL, структура доменов USP UBL показывает β-складчатую структуру. [22] [23]
Одиночные или множественные тандемные домены DUSP из приблизительно 120 остатков обнаружены в шести USP. Функция домена DUSP в настоящее время неизвестна, но он может играть роль во взаимодействии белок-белок , в частности, в распознавании субстрата DUB. Это предсказано из-за гидрофобной щели, присутствующей в домене DUSP USP15, и того, что некоторые взаимодействия белков с DUSP, содержащими USP, не происходят без этих доменов. Домен DUSP демонстрирует новую складку, похожую на трипод, состоящую из трех спиралей и антипараллельного бета-слоя, состоящего из трех нитей. Эта складка напоминает ножки (спирали) и сиденье (бета-слоя) трипода. В большинстве доменов DUSP в USP есть консервативная последовательность аминокислот, известная как мотив PGPI . Это последовательность из четырех аминокислот: пролина , глицина , пролина и изолейцина , которая упаковывается против трехспирального пучка и является высокоупорядоченной. [6] [24]
Полную степень роли DUB в заболеваниях еще предстоит выяснить. Их участие в заболеваниях прогнозируется из-за известных ролей в физиологических процессах, которые вовлечены в болезненные состояния; включая рак и неврологические расстройства. [25]
Фермент USP28 сверхэкспрессируется в различных типах рака , таких как рак толстой кишки или легких. Кроме того, USP28 деубиквитинирует и стабилизирует важные онкогены, такие как c-Myc , Notch1 , c-jun или ΔNp63 . [26] [27] [28] В плоскоклеточных опухолях USP28 регулирует устойчивость к химиотерапии, регулируя восстановление ДНК через ось пути ΔNp63 -Fanconia anemia. [29]
Деубиквитинирующие ферменты UCH-L3 и YUH1 способны гидролизовать мутантный убиквитин UBB+1, несмотря на то, что глицин в позиции 76 мутировал. [30]
Уровень UCH-L1 высок при различных типах злокачественных новообразований ( рак ). [31]
DUB играют активную роль в модуляции клеточного цикла. Убиквитин-специфическая протеаза (USP) — это семейство деубиквитинирующих ферментов, которые играют решающую роль в регуляции клеточного цикла. [32] Два таких фермента включают USP17 и USP44. USP17 регулирует пути, ответственные за продвижение клеток по клеточному циклу. [33] Его мишенями являются регуляторы Ras, CDK2 и Cyclin A. [34] USP44 играет важную роль в инициации анафазы. [35] Новые исследования митотической контрольной точки выявили новую роль USP44 в регуляции прогрессирования клеточного цикла. [35]
Путь ERK позволяет трансдуцировать внешние митогенные сигналы во внутриклеточные сигналы, способствующие клеточной пролиферации. Одним из ключевых регуляторов этого пути является Ras, ГТФаза, которая при активации связывает ГТФ, чтобы «включить» последующий каскад сигналов. Ras-конвертирующий фермент 1 (RCE1) посттрансляционно расщепляет 3 остатка на С-конце Ras, позволяя Ras правильно локализоваться на плазматической мембране. [36]
USP17 действует, чтобы деубиквитинировать домены K63-убиквитина на RCE1. [34] Такая стабилизация RCE1 обеспечивает правильную локализацию Ras, тем самым способствуя пролиферации при активации ранних рецепторов в пути ERK. Гиперактивность Ras может привести к нарушению регуляции клеточного цикла. [37] Таким образом, регуляция Ras через USP17 действует как еще одна точка в регуляции Ras.
Циклинзависимые киназы (CDK) представляют собой семейство ферментов, которые фосфорилируют остатки серина и треонина, чтобы провести клетку через клеточный цикл. Активация CDK2 имеет решающее значение для перехода G1-S. Для активации CDK2 циклин А должен связаться с комплексом циклинзависимой киназы (CDKC). Цикл деления клеток 25A (CDC25A) представляет собой фосфатазу, которая удаляет ингибирующую фосфатную группу из CDK2. [38] В то время как убиквитинирование помечает CDC25A для деградации, тем самым блокируя прогрессирование в фазу S, USP17 деубиквитинирует CDC25A. [34] Повышение стабильности CDC25A способствует активности CDKC, тем самым проводя клетку через переход G1-S.
USP17 также регулирует прогрессирование клеточного цикла, воздействуя на SETD8 для подавления транскрипции ингибитора циклинзависимой киназы 1 (CDKN1A), также известного как p21. [34] CDKN1A связывается с CDK2 и ингибирует его, используя свой N-концевой связывающий домен, тем самым блокируя прогрессирование через переход G1-S. SETD8, метилтрансфераза, использует S-аденозилметионин для метилирования остатка Lys20 гистона 4, что приводит к конденсации хромосом. [39] Это уплотнение ДНК подавляет транскрипцию CDKN1A. USP17 деубиквитинирует SETD8, тем самым снижая его склонность к деградации и увеличивая его внутриклеточную стабильность. [34] Результирующее подавление транскрипции CDKN1A способствует активности CDK2, позволяя клетке проходить через переход G1-S. См. схему роли DUB в регуляции клеточного цикла. [34]

Контрольная точка веретена (также называемая митотической контрольной точкой) обеспечивает правильное разделение хромосом. В широком смысле, митотическая контрольная точка способствует точности в хромосомной сегрегации, увеличивая вероятность того, что каждая дочерняя клетка получит только одну дублированную хромосому. [40] Такой механизм имеет решающее значение, поскольку ошибки в хромосомном разделении были связаны с раком, врожденными дефектами и устойчивостью к антибиотикам у патогенов. [41] Одним из основных регуляторных белков является комплекс, способствующий анафазе (APC/C). APC/C убиквитинирует секурин. [42] В результате происходит разрушение скрепляющего высвобождения сепаразы, [40] которая гидролизует сплоченность — белок, который связывает сестринские хроматиды вместе.
Новое исследование Стегмейера и коллег [35], опубликованное в журнале Nature, демонстрирует решающую роль USP44 в регуляции контрольной точки веретена. С помощью скрининга shRNA было идентифицировано, что USP44 стабилизирует ингибирование APC/C [35] Связывание CDC20 с APC/C необходимо для убиквитинирования секурина. [43] Белок, называемый hMAD2, может образовывать неактивный тример с APC и CDC20, образуя комплекс hMAD2-CDC-APC. [43] После убиквитинирования CDC20 с помощью UbcH10 hMAD2 диссоциирует, и APC/C становится активным. [44] Важно отметить, что убиквитинирование CDC20 не служит для его маркировки для деградации, а скорее способствует диссоциации hMAD2 из комплекса hMAD2-CDC-APC. USP44, специфичная для убиквитина протеаза, может стабилизировать неактивный комплекс hMAD2-CDC-APC, противодействуя убиквитинированию UbcH10. Это блокирует диссоциацию hMAD2 и позволяет правильно регулировать APC/C, сохраняя его неактивным до правильного прикрепления митотического веретена. При правильном прикреплении поведение, подобное переключателю, позволяет активировать APC/C. [35] Это приводит к разрыву когезии, что позволяет разделить сестринские хроматиды.
Повреждение ДНК может оказаться катастрофическим для организма. Механизмы мутации ДНК включают окислительный стресс, ошибки репликации ДНК, экзогенные канцерогены, радиацию и спонтанную мутацию оснований. При повреждении ДНК прогрессирование клеточного цикла останавливается, чтобы предотвратить распространение мутации. Ген TP53 (также известный как p53) имеет решающее значение для обеспечения сохранения генома. [45] Деубиквитинирующие ферменты играют неотъемлемую роль в поддержании функции p53.
В здоровых клетках p53 активирует убиквитинлигазу E3 MDM2, которая, в свою очередь, убиквитинирует p53. Это создает отрицательную обратную связь, в результате чего деградация p53 позволяет клеткам проходить через клеточный цикл. При повреждении ДНК специфичная для убиквитина протеаза 7 (USP7) стабилизирует p53, расщепляя убиквитин. [46] Для того чтобы USP7 деубиквитинировал p53, он должен локализоваться в ядре. Однако последовательность ядерной локализации (NLS) не обнаружена. [47] Несмотря на отсутствие известной NLS, одно исследование показало, что при удалении N-конца USP7 ядерной локализации не произошло. [47] Возможно, что другие белки облегчают проникновение USP7 в ядро.
После стабилизации p53 может выполнять свою функцию подавления опухолей. Нижестоящие пути p53 действуют либо на остановку прогрессирования клеточного цикла в фазах G1 или G2 клеточного цикла [48], либо способствуют гибели клеток, в зависимости от тяжести повреждения ДНК. [49] См. схему роли USP7 в p53-зависимом пути. [48] или способствуют гибели клеток, в зависимости от тяжести повреждения ДНК. [49] См. схему роли USP7 в p53-зависимом пути. [49]

{{cite book}}: |journal=проигнорировано ( помощь )