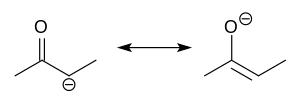
В органической химии еноляты — это органические анионы , полученные в результате депротонирования карбонильных ( RR'C=O ) соединений. Редко выделяемые, они широко используются в качестве реагентов в синтезе органических соединений . [1] [ 2] [3] [4]

Енолят-анионы электронно связаны с аллильными анионами. Анионный заряд делокализован по кислороду и двум углеродным участкам. Таким образом, они имеют характер как алкоксида, так и карбаниона . [5]
Хотя их часто изображают как простые соли, на самом деле они имеют сложную структуру, часто включающую агрегаты. [6]

Депротонирование енолизируемых кетонов, ароматических спиртов, альдегидов и эфиров дает еноляты. [8] [9] С сильными основаниями депротонирование количественное. Обычно еноляты получаются с использованием диизопропиламида лития (LDA). [10]
Часто, как и в обычных конденсациях Клайзена , реакциях Манниха и альдольных конденсациях , еноляты образуются в низких концентрациях с алкоксидными основаниями. В таких условиях они существуют в низких концентрациях, но все равно вступают в реакции с электрофилами. На поведение енолятов влияют многие факторы, особенно растворитель, добавки (например, диамины) и противокатион (Li + против Na + и т. д.). Для несимметричных кетонов существуют методы контроля региохимии депротонирования. [11]

Депротонирование углеродных кислот может протекать с кинетическим или термодинамическим контролем реакции . Например, в случае фенилацетона депротонирование может давать два разных енолята. Было показано, что LDA депротонирует метильную группу, что является кинетическим ходом депротонирования. Чтобы обеспечить получение кинетического продукта, используется небольшой избыток (1,1 экв.) диизопропиламида лития, а кетон добавляется к основанию при -78 °C. Поскольку кетон быстро и количественно превращается в енолят, а основание присутствует в избытке все время, кетон не может действовать как протонный челнок для катализа постепенного образования термодинамического продукта. Более слабое основание, такое как алкоксид , который обратимо депротонирует субстрат, дает более термодинамически стабильный бензильный енолят.
Еноляты могут быть захвачены ацилированием и силилированием , которые происходят при кислороде. Силиловые эфиры енолов являются обычными реагентами в органическом синтезе, как показано на примере альдольной реакции Мукаямы : [13]

Помимо использования сильных оснований, еноляты могут быть получены с использованием кислоты Льюиса и слабого основания («мягкие условия»):

Для того чтобы произошла депротонация , стереоэлектронное требование заключается в том, что сигма-связь альфа-СН должна иметь возможность перекрываться с pi*-орбиталью карбонила :
Были проведены обширные исследования по образованию енолятов. Геометрию енолята можно контролировать: [14]

Для кетонов большинство условий енолизации дают еноляты Z. Для эфиров большинство условий енолизации дают еноляты E. Известно, что добавление HMPA меняет стереоселективность депротонирования.

Стереоселективное образование енолятов было рационализировано с помощью модели Ирландии , [15] [16] [17] [18], хотя ее обоснованность несколько сомнительна. В большинстве случаев неизвестно, какие промежуточные продукты, если таковые имеются, являются мономерными или олигомерными по своей природе; тем не менее, модель Ирландии остается полезным инструментом для понимания енолятов.

В модели Айрленда предполагается, что депротонирование происходит посредством шестичленного или циклического [19] мономерного переходного состояния . Больший из двух заместителей на электрофиле (в приведенном выше случае метил больше протона) принимает экваториальное расположение в предпочтительном переходном состоянии, что приводит к предпочтению енолятов E. Модель явно терпит неудачу во многих случаях; например, если смесь растворителей меняется с ТГФ на 23% ГМФА-ТГФ (как показано выше), геометрия енолята меняется на противоположную, что не согласуется с этой моделью и ее циклическим переходным состоянием.
Если несимметричный кетон подвергается воздействию основания, он имеет потенциал для образования двух региоизомерных енолятов (игнорируя геометрию енолята). Например:

Тризамещенный енолят считается кинетическим енолятом, в то время как тетразамещенный енолят считается термодинамическим енолятом. Альфа-водород, депротонированный с образованием кинетического енолята, менее затруднен, и поэтому депротонируется быстрее. В целом, тетразамещенные олефины более стабильны, чем тризамещенные олефины, из-за гиперконъюгативной стабилизации. Соотношение региоизомеров енолята сильно зависит от выбора основания. Для приведенного выше примера кинетический контроль может быть установлен с помощью LDA при −78 °C, что дает селективность 99:1 кинетический енолят: термодинамический енолят, в то время как термодинамический контроль может быть установлен с помощью трифенилметиллития при комнатной температуре , что дает селективность 10:90.
В целом, кинетические еноляты благоприятствуют холодным температурам, условиям, которые дают относительно ионную связь металл-кислород, и быстрому депротонированию с использованием небольшого избытка сильного, стерически затрудненного основания. Большое основание депротонирует только более доступный водород, а низкие температуры и избыток основания помогают избежать уравновешивания с более стабильным альтернативным енолятом после первоначального образования енолята. Термодинамические еноляты благоприятствуют более длительному времени уравновешивания при более высоких температурах, условиям, которые дают относительно ковалентную связь металл-кислород, и использованию небольшого субстехиометрического количества сильного основания. Используя недостаточное количество основания для депротонирования всех молекул карбонилов, еноляты и карбонилы могут обмениваться протонами друг с другом и уравновешиваться до своего более стабильного изомера. Использование различных металлов и растворителей может обеспечить контроль над количеством ионного характера в связи металл-кислород.
Как мощные нуклеофилы, еноляты реагируют с различными электрофилами. На стереоселективность и региоселективность влияют добавки, растворитель, противоионы и т. д. Когда электрофилами являются алкилгалогениды, возникает классическая проблема: O-алкилирование против C-алкилирования . Управление этой селективностью привлекло много внимания. Отрицательный заряд в енолятах сосредоточен на кислороде, но этот центр также сильно сольватирован, что приводит к C-алкилированию. [20]
Другими важными электрофилами являются альдегиды/кетоны и акцепторы Михаэля . [21]
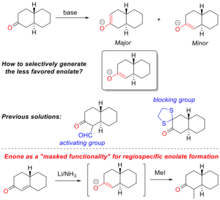

Региоспецифическое образование — это контролируемое образование енолята путем специфического депротонирования одного из α-углеродов исходной молекулы кетона. Это обеспечивает одну из наиболее понятных синтетических стратегий для введения химической сложности в синтезы природных продуктов и общие синтезы . Ярким примером его использования является общий синтез прогестерона, показанный на рисунке «Образование региоспецифического енолята в общем синтезе прогестерона».
При обработке кетонов основанием еноляты могут быть образованы путем депротонирования на любом α-углероде. Селективность определяется как стерическими , так и электронными эффектами на α-углеродах, а также точным используемым основанием (см. рисунок ««Скрытая функциональность» для региоспецифического образования енолята» для примера). Образование енолята будет термодинамически благоприятствоваться самому кислому протону, что зависит от электронной стабилизации полученного аниона . Однако селективность может быть обращена вспять путем стерического затруднения термодинамического продукта и, следовательно, кинетического благоприятствования депротонированию на другом α-углеродном центре. Традиционные методы региоселективного образования енолята используют либо электронные активирующие группы (например, альдегиды ), либо стерические блокирующие группы (например, кетон, защищенный 1,2-этандитиол ).
Енон также может служить предшественником для региоспецифического образования енолята, здесь енон является «замаскированной функциональностью» для енолята. Этот процесс впервые описан Гилбертом Сторком [22] , который наиболее известен своим вкладом в изучение методов селективного образования енолята в органическом синтезе . Реакция енона с металлическим литием приводит к образованию енолята на α-углероде енона. Продукт енолята может быть либо захвачен, либо алкилирован. Используя «замаскированную функциональность», можно получать еноляты, которые недоступны традиционными методами.
Подход «замаскированной функциональности» к региоспецифическому образованию енолята широко использовался в общем синтезе природных продуктов. Например, в общем синтезе стероидного гормона прогестерона [23] Сторк и его коллеги использовали «замаскированную функциональность» для стереоспецифического построения одного из четвертичных атомов углерода в молекуле.
Азаеноляты (также известные как иминовые анионы, енамиды, металлированные основания Шиффа и металлоенамины) являются азотистыми аналогами енолятов. [24] Когда имины обрабатываются сильными основаниями, такими как LDA , образуются высоконуклеофильные азаеноляты.

Главное преимущество использования азаенолятов заключается в том, что они не подвергаются самоконденсации (т. е. альдольной реакции для альдегидов ) в основном или нейтральном растворе, а скорее способствуют алкилированию на альфа-углероде. [25] Это происходит главным образом потому, что имины содержат двойные связи углерод-азот в отличие от альдегидов, которые содержат двойные связи кислород-углерод. Поскольку кислород более электроотрицателен, чем азот, он отнимает больше электронной плотности от карбонильного углерода, вызывая больший частично положительный заряд на углероде. Следовательно, с более электрофильным углеродом альдегиды обеспечивают лучшее нуклеофильное присоединение к углероду на двойной связи углерод-кислород.
С другой стороны, имин имеет меньше электроотрицательного азота, что индуцирует более слабый частично положительный заряд на карбониле-углероде. В результате, хотя имины все еще могут реагировать с литийорганическими соединениями, они не реагируют с другими нуклеофилами (включая азаеноляты) для прохождения нуклеофильных присоединений . [26]
Вместо этого азаеноляты реагируют аналогично енолятам, образуя алкилированные продукты SN2 . [25] Благодаря сопряжению неподеленной пары азота β-углерод становится нуклеофильным сайтом, позволяя азаенолятам подвергаться реакциям алкилирования. [27] Таким образом, азаеноляты могут реагировать с многочисленными электрофилами, такими как эпоксиды и алкилгалогениды, образуя новую углерод-углеродную связь на β-углероде. [24]
Ниже показаны два потенциальных механизма реакции:

Поскольку эпоксид представляет собой трехчленную кольцевую молекулу, он имеет высокую степень кольцевого напряжения . Хотя атомы углерода в кольцевой системе являются тетраэдрическими , предпочитая 109,5 градусов между каждым атомом, эпоксид растягивает углы кольца до 60 градусов. Чтобы противостоять этому эффекту, нуклеофильные азаеноляты легко реагируют с эпоксидами, уменьшая их кольцевые напряжения.

Помимо реакции с эпоксидами, азаеноляты могут также реагировать с алкилгалогенидами (или аллилгалогенидами, как показано выше) с образованием новой углерод-углеродной сигма-связи . Эта реакция является одним из ключевых этапов в синтезе феромона мужской агрессии, Oulema melanopus. [29] Азаенолят образуется при реакции LDA с пивоальдегидом, который затем реагирует с алкилгалогенидом с образованием промежуточного продукта Oulema melanopus.
Азаеноляты также могут образовываться с реактивами Гриньяра и реагировать с другими мягкими электрофилами, включая рецепторы Михаэля . [24]