Лимонная батарейка — это простая батарейка, часто изготавливаемая в образовательных целях. Обычно в лимон вставляют кусок цинкового металла (например, оцинкованный гвоздь) и кусок меди (например, пенни) и соединяют их проводами. Энергия, вырабатываемая в результате реакции металлов, используется для питания небольшого устройства, например, светодиода .
Лимонная батарея похожа на первую электрическую батарею, изобретенную в 1800 году Алессандро Вольта , который использовал рассол (соленую воду) вместо лимонного сока. [1] Лимонная батарея иллюстрирует тип химической реакции ( окислительно-восстановительный ), который происходит в батареях. [2] [3] [4] Цинк и медь называются электродами , а сок внутри лимона называется электролитом . Существует много разновидностей лимонной ячейки, в которых в качестве электролитов используются различные фрукты (или жидкости), а в качестве электродов — металлы, отличные от цинка и меди.
Существует множество наборов инструкций по изготовлению лимонных батареек и получению таких компонентов, как светодиоды (LED), электрические счетчики ( мультиметры ) и оцинкованные (гальванизированные ) гвозди и шурупы. [5] [6] Коммерческие научные наборы «картофельные часы» включают электроды и низковольтные цифровые часы. После сборки одной ячейки можно использовать мультиметр для измерения напряжения или электрического тока от гальванического элемента; типичное напряжение составляет 0,9 В с лимонами. Токи более изменчивы, но варьируются примерно до 1 мА (чем больше поверхности электродов, тем больше ток). Для более заметного эффекта лимонные элементы можно соединить последовательно для питания светодиода (см. иллюстрацию) или других устройств. Последовательное соединение увеличивает напряжение, доступное для устройств. Свартлинг и Морган опубликовали список низковольтных устройств вместе с соответствующим количеством лимонных элементов, которые были необходимы для их питания; они включали светодиоды, пьезоэлектрические зуммеры и небольшие цифровые часы. С цинково-медными электродами для любого из этих устройств требовалось не менее двух лимонных ячеек. [7] Замена цинкового электрода на магниевый делает ячейку с большим напряжением (1,5−1,6 В), и одна магниево-медная ячейка будет питать некоторые устройства. [7] Обратите внимание, что лампы накаливания из фонариков не используются, поскольку лимонная батарея не рассчитана на выработку достаточного для их освещения электрического тока. Такая батарея обычно вырабатывает 0,001 А (1 мА) тока при разности потенциалов 0,7 В; эти значения умножаются, чтобы определить общую мощность 0,0007 Вт (0,7 мВт).

Многие фрукты и жидкости можно использовать в качестве кислотного электролита. Фрукты удобны, поскольку они обеспечивают как электролит, так и простой способ поддержки электродов. Кислота, содержащаяся в цитрусовых (лимонах, апельсинах, грейпфрутах и т. д.), — это лимонная кислота . Кислотность, которая указывается измеренным pH , существенно варьируется.
Картофель содержит фосфорную кислоту и хорошо работает; он является основой для коммерческих наборов «картофельных часов». [8] [9] Картофельные батареи со светодиодным освещением были предложены для использования в бедных странах или населением, не подключенным к электросети. Международные исследования, начатые в 2010 году, показали, что кипячение картофеля в течение восьми минут улучшает его электрическую мощность, как и размещение ломтиков картофеля между несколькими медными и цинковыми пластинами. По словам исследователей из Шри-Ланки, отваренная и измельченная сердцевина (стебель) банана также подходит. [10]
Вместо фруктов можно использовать жидкости в различных емкостях. Хорошо подойдет бытовой уксус ( уксусная кислота ). [11] Квашеная капуста ( молочная кислота ) была показана в одном из эпизодов американской телевизионной программы Head Rush (ответвление программы MythBusters ). Квашеная капуста была законсервирована и стала электролитом, в то время как сама банка была одним из электродов. [12]
Цинковые и медные электроды достаточно безопасны и их легко получить. Другие металлы, такие как свинец, железо, магний и т. д., также могут быть изучены; они дают иное напряжение, чем пара цинк/медь. В частности, магниевые/медные электроды могут генерировать напряжение до 1,6 В в лимонных элементах. Это напряжение больше, чем можно получить с помощью цинковых/медных элементов. Оно сопоставимо с напряжением стандартных бытовых батареек (1,5 В), что полезно при питании устройств с одним элементом вместо использования элементов последовательно. [7]
Для самых младших учеников, в возрасте от 5 до 9 лет, образовательная цель утилитарна: [13] батареи — это устройства, которые могут питать другие устройства, если они соединены проводящим материалом. Батареи — это компоненты в электрических цепях; подключение одного провода между батареей и лампочкой не будет питать лампочку.
Для детей в возрасте 10−13 лет батарейки используются для иллюстрации связи между химией и электричеством, а также для углубления концепции цепи для электричества. Тот факт, что используются различные химические элементы, такие как медь и цинк, можно поместить в более широкий контекст, что элементы не исчезают и не разрушаются, когда они подвергаются химическим реакциям.
Для старших школьников и студентов колледжей батареи служат для иллюстрации принципов окислительно-восстановительных реакций. [13] [14] Студенты могут обнаружить, что два одинаковых электрода не дают напряжения и что разные пары металлов (помимо меди и цинка) дают разное напряжение. Можно исследовать напряжения и токи от последовательных и параллельных комбинаций батарей. [15]
Ток, который батарея выдает через счетчик, будет зависеть от размера электродов, от того, насколько глубоко они вставлены в фрукт, и от того, насколько близко друг к другу они расположены; напряжение практически не зависит от этих характеристик электродов. [16]
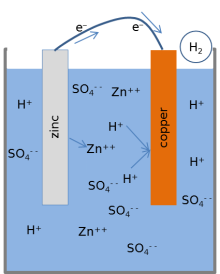
Большинство учебников представляют следующую модель химических реакций лимонной батарейки. [1] [3] [17] Когда ячейка обеспечивает электрический ток через внешнюю цепь, металлический цинк на поверхности цинкового электрода растворяется в растворе. Атомы цинка растворяются в жидком электролите как электрически заряженные ионы (Zn 2+ ), оставляя 2 отрицательно заряженных электрона (e − ) в металле:
Эта реакция называется окислением . При попадании цинка в электролит два положительно заряженных иона водорода (H + ) из электролита соединяются с двумя электронами на поверхности медного электрода и образуют незаряженную молекулу водорода (H2 ) :
Эта реакция называется восстановлением. Электроны, используемые в меди для образования молекул водорода, переносятся из цинка через внешний провод, соединяющий медь и цинк. Молекулы водорода, образованные на поверхности меди в результате реакции восстановления, в конечном итоге улетучиваются в виде газообразного водорода.
Эта модель химических реакций делает несколько прогнозов, которые были исследованы в экспериментах, опубликованных Джерри Гудисменом в 2001 году. Гудисмен отмечает, что многочисленные недавние авторы предлагают химические реакции для лимонной батареи, которые включают растворение медного электрода в электролите. Гудисмен исключает эту реакцию как несоответствующую экспериментам и отмечает, что правильная химия, которая включает выделение водорода на медном электроде, но также может использовать серебро вместо меди, известна уже много лет. [4] Большинство подробных прогнозов модели относятся к напряжению батареи, которое измеряется непосредственно измерителем при разомкнутой цепи (ничего другого не подключено к батарее). Когда электролит был изменен путем добавления сульфата цинка (ZnSO4 ) , напряжение от элемента было снижено, как и предсказывалось с использованием уравнения Нернста для модели. Уравнение Нернста по сути говорит, насколько падает напряжение по мере добавления большего количества сульфата цинка. Добавление сульфата меди (CuSO4 ) не повлияло на напряжение. Этот результат согласуется с тем фактом, что атомы меди из электрода не участвуют в модели химической реакции для ячейки.
Когда батарея подключена к внешней цепи и протекает значительный электрический ток, цинковый электрод теряет массу, как и предсказывает реакция окисления цинка выше. Аналогично, водородный газ выделяется в виде пузырьков из медного электрода. Наконец, напряжение от элемента зависело от кислотности электролита, измеряемой его pH; уменьшение кислотности (и увеличение pH) приводит к падению напряжения. Этот эффект также предсказывает уравнение Нернста; конкретная кислота, которая использовалась (лимонная, соляная, серная и т. д.), не влияет на напряжение, кроме как через значение pH.
Предсказание уравнения Нернста не сработало для сильнокислых электролитов (pH < 3,4), когда цинковый электрод растворяется в электролите, даже когда батарея не подает ток в цепь. Две окислительно-восстановительные реакции, перечисленные выше, происходят только тогда, когда электрический заряд может передаваться через внешнюю цепь. Дополнительную реакцию разомкнутой цепи можно наблюдать по образованию пузырьков на цинковом электроде при разомкнутой цепи. Этот эффект в конечном итоге ограничил напряжение ячеек до 1,0 В вблизи комнатной температуры при самых высоких уровнях кислотности.
Энергия поступает из химического изменения цинка, когда он растворяется в кислоте. Энергия не поступает из лимона или картофеля. Цинк окисляется внутри лимона, обмениваясь некоторыми своими электронами с кислотой, чтобы достичь более низкого энергетического состояния, и высвобождаемая энергия обеспечивает мощность. [4]
В современной практике цинк производится путем электролиза сульфата цинка или пирометаллургического восстановления цинка углеродом, что требует затрат энергии. Энергия, вырабатываемая в лимонной батарее, получается путем обращения этой реакции, что позволяет восстановить часть затрат энергии во время производства цинка.
С 1840 года до конца 19 века в полиграфической промышленности широко использовались большие гальванические элементы с цинковым электродом и сернокислотным электролитом. Хотя иногда использовались медные электроды, подобные тем, что используются в лимонных батареях, в 1840 году Альфред Сми изобрел усовершенствованную версию этого элемента, в котором вместо медного электрода использовалось серебро с грубым платиновым покрытием. [18] [19] Водородный газ, прилипающий к поверхности серебряного или медного электрода, уменьшает электрический ток, который может быть получен из элемента; это явление называется «поляризацией». [17] [20] Шероховатая, «платинированная» поверхность ускоряет барботирование водородного газа и увеличивает ток из элемента. В отличие от цинкового электрода, медные или платинированные серебряные электроды не расходуются при использовании батареи, и детали этого электрода не влияют на напряжение элемента. Элемент Сми был удобен для гальванопластики , которая производила медные пластины для высокой печати газет и книг, а также статуй и других металлических предметов. [19] [21] [22] [23] [24]
В ячейке Сми использовался амальгамированный цинк вместо чистого цинка; поверхность амальгамированного цинка была обработана ртутью . [23] По-видимому, амальгамированный цинк был менее подвержен деградации под воздействием кислотного раствора, чем чистый цинк. [25] Амальгамированные цинковые и простые цинковые электроды дают по сути одинаковое напряжение, когда цинк чистый. [26] При использовании несовершенно очищенного цинка в лабораториях 19 века они обычно давали разное напряжение. [25]
Раньше гальваническая батарея была колоссальной и дорогой машиной, занимавшей большое пространство и требовавшей значительных затрат на поддержание ее в состоянии недолговечного действия. Теперь гораздо более мощный инструмент можно сделать в табакерке и носить в кармане. Эти замечания навязаны нам удивительными платиновыми батареями г-на Гроува и химико-механическими батареями, изобретенными г-ном Сми...
Первое реальное усовершенствование по сравнению с простым цинково-медным элементом в кислоте было сделано доктором Альфредом Сми, который заметил, что водородный газ, выделяющийся на отрицательной пластине, выделялся из нее гораздо легче, поэтому поляризация происходила гораздо медленнее, если поверхность этой пластины была шероховатой, а не совсем гладкой; и наиболее эффективным он нашел способ покрытия серебряного листа или листов мелкодисперсной платиной...
Из применения этой ячейки можно сделать очень важную модификацию, превратив ее в
батарею
КИСЛОТЫ , аналогичную платинированному серебру г-на Сми. Те, кто знаком с гениальным устройством этого джентльмена, знают, что особенностью его устройства является то, что отрицательная пластина, где выделяется водород, очень легко расстается с этим водородом. При обычных обстоятельствах водород очень сильно прилипает к пластинам кислотной батареи и выводит значительную часть пластин из строя своим присутствием на их поверхностях. Чтобы исправить это, он, как он это называет, "платинировал" поверхности.
В 1840 году Сми изобрел батарею, которая сделала электротипирование возможным в коммерческих целях. ... Возможно, один из самых больших шагов вперед в связи с электротипированием был сделан, когда была изобретена гальваническая динамо-машина. Первое внедрение динамо-машины вместо батареи типа Сми было осуществлено Лесли из Нью-Йорка в 1872 году.Учебник для учеников в полиграфии. Хорошее краткое введение в историю электротипирования.
Ячейка Сми является наиболее часто используемой ячейкой из-за ее чрезвычайной простоты конструкции и управления.Подробное обсуждение строительства и обслуживания камер Сми, ок. 1874 г.
Некоторые чрезвычайно важные заказы были выполнены с помощью электротипии, например, «бронзы», украшающие Оперу в Париже, и статуя принца Альберта высотой 320 см и четыре сопровождающие ее фигуры, воздвигнутая позади Альберт-холла в Лондоне в память о Великой выставке 1851 года.
Уникальное свойство амальгамированного цинка не подвергаться воздействию серной кислоты, разбавленной водой, обусловлено адгезией водорода на пластине в кислотном растворе.