В металлоорганической химии принцип изолобальности (более формально известный как изолобальная аналогия ) представляет собой стратегию, используемую для соотнесения структуры органических и неорганических молекулярных фрагментов с целью прогнозирования связывающих свойств металлоорганических соединений. [1] Роальд Хоффман описал молекулярные фрагменты как изолобальные, «если число, свойства симметрии , приблизительная энергия и форма граничных орбиталей и число электронов в них схожи — не идентичны, но схожи». [2] Можно предсказать связывание и реакционную способность менее известного вида по более известному виду, если два молекулярных фрагмента имеют схожие граничные орбитали, наивысшую занятую молекулярную орбиталь (HOMO) и низшую незанятую молекулярную орбиталь (LUMO). Изолобальные соединения являются аналогами изоэлектронных соединений, которые имеют одинаковое число валентных электронов и структуру. Графическое изображение изолобальных структур, где изолобальные пары соединены посредством двусторонней стрелки с половиной орбитали ниже, представлено на рисунке 1.
За свою работу по изолобальной аналогии Хоффман был удостоен Нобелевской премии по химии в 1981 году, которую он разделил с Кенити Фукуи . [3] В своей Нобелевской лекции Хоффман подчеркнул, что изолобальная аналогия является полезной, но простой моделью и, таким образом, в определенных случаях она обречена на неудачу. [1]
Чтобы начать генерировать изолобальный фрагмент, молекула должна соответствовать определенным критериям. [4] Молекулы, основанные на элементах главной группы, должны удовлетворять правилу октета, когда все связывающие и несвязывающие молекулярные орбитали (МО) заполнены, а все антисвязывающие МО пусты. Например, метан — это простая молекула, из которой можно сформировать фрагмент главной группы. Удаление атома водорода из метана генерирует метильный радикал. Молекула сохраняет свою молекулярную геометрию , поскольку граничная орбиталь указывает в направлении отсутствующего атома водорода. Дальнейшее удаление водорода приводит к образованию второй граничной орбитали. Этот процесс можно повторять до тех пор, пока не останется только одна связь с центральным атомом молекулы.
Изолобальные фрагменты октаэдрических комплексов , таких как тип ML 6 , могут быть созданы аналогичным образом. Комплексы переходных металлов должны изначально удовлетворять правилу восемнадцати электронов , не иметь чистого заряда, а их лиганды должны быть двумя донорами электронов ( основания Льюиса ). Следовательно, металлический центр для начальной точки ML 6 должен быть d 6 . Удаление лиганда аналогично удалению водорода метана в предыдущем примере, что приводит к пограничной орбитали, которая указывает на удаленный лиганд. Разрыв связи между металлическим центром и одним лигандом приводит к образованию ML−
5Радикальный комплекс. Для того чтобы удовлетворить критерию нулевого заряда, необходимо изменить центр металла. Например, комплекс MoL 6 является d 6 и нейтральным. Однако удаление лиганда для формирования первой граничной орбитали приведет к MoL−
5комплекс, потому что Mo получил дополнительный электрон, сделав его d 7 . Чтобы исправить это, Mo можно обменять на Mn, что в этом случае приведет к образованию нейтрального комплекса d 7 , как показано на рисунке 3. Эта тенденция может продолжаться до тех пор, пока не останется только один лиганд, скоординированный с металлическим центром.

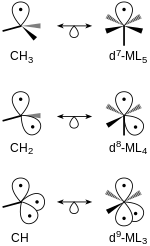
Изолобальные фрагменты тетраэдрических и октаэдрических молекул могут быть связаны. Структуры с одинаковым числом граничных орбиталей изолобальны друг другу. Например, метан с двумя удаленными атомами водорода, CH 2, изолобален комплексу ad 7 ML 4 , образованному из октаэдрического исходного комплекса (рисунок 4).
Любой вид насыщенной молекулы может быть отправной точкой для создания изолобальных фрагментов. [5] [6] Связывающие и несвязывающие молекулярные орбитали (МО) молекулы должны быть заполнены, а разрыхляющие МО пустыми. С каждым последующим созданием изолобального фрагмента электроны удаляются из связывающих орбиталей и создается граничная орбиталь. Граничные орбитали находятся на более высоком энергетическом уровне, чем связывающие и несвязывающие МО. Каждая граничная орбиталь содержит один электрон. Например, рассмотрим рисунок 5, на котором показано создание граничных орбиталей в тетраэдрических и октаэдрических молекулах.

Как показано выше, когда фрагмент образуется из CH 4 , одна из sp 3 гибридных орбиталей, участвующих в связывании, становится несвязывающей однократно занятой граничной орбиталью. Повышенный уровень энергии граничной орбитали также показан на рисунке. Аналогично, когда начинаем с металлического комплекса, такого как d 6 -ML 6 , затрагиваются d 2 sp 3 гибридные орбитали. Кроме того, несвязывающие металлические орбитали t 2g не изменяются.
Изолобальная аналогия имеет приложения за пределами простых октаэдрических комплексов. Она может быть использована с различными лигандами, заряженными видами и неоктаэдрическими комплексами. [7]
Изолобальную аналогию можно также использовать с изоэлектронными фрагментами, имеющими одинаковое координационное число, что позволяет рассматривать заряженные виды. Например, Re(CO) 5 является изолобальным с CH 3 и, следовательно, [Ru(CO) 5 ] + и [Mo(CO) 5 ] − также являются изолобальными с CH 3 . Любой 17-электронный металлический комплекс будет изолобальным в этом примере.
В аналогичном смысле, добавление или удаление электронов из двух изолобальных фрагментов приводит к двум новым изолобальным фрагментам. Поскольку Re(CO) 5 изолобален с CH 3 , [Re(CO) 5 ] + изолобален с CH+
3. [8]

Аналогия применима к другим формам, помимо тетраэдрической и октаэдрической геометрий. Выводы, используемые в октаэдрической геометрии, действительны для большинства других геометрий. Исключением является квадратно-плоский, поскольку квадратно-плоские комплексы обычно подчиняются правилу 16 электронов. Предполагая, что лиганды действуют как доноры двух электронов, металлический центр в квадратно-плоских молекулах — это d 8 . Чтобы связать октаэдрический фрагмент ML n , где M имеет конфигурацию электронов ad x , с квадратно-плоским аналогичным фрагментом, следует следовать формуле ML n −2 , где M имеет конфигурацию электронов ad x +2 .
Дополнительные примеры изоглобальной аналогии в различных формах и видах показаны на рисунке 8.