Иммунный ответ — это физиологическая реакция, которая происходит в организме в контексте воспаления с целью защиты от экзогенных факторов. К ним относятся широкий спектр различных токсинов , вирусов , внутри- и внеклеточных бактерий , простейших , гельминтов и грибков , которые могут вызвать серьезные проблемы со здоровьем организма-хозяина, если их не вывести из организма. [1]
Кроме того, существуют и другие формы иммунного ответа. Например, безвредные экзогенные факторы (такие как пыльца и компоненты пищи) могут вызывать аллергию ; латекс и металлы также известны как аллергены. Трансплантированная ткань (например, кровь) или орган могут вызывать реакцию «трансплантат против хозяина» . Тип иммунной реактивности, известный как резус-конфликт, может наблюдаться у беременных женщин. Эти особые формы иммунного ответа классифицируются как гиперчувствительность . Другая особая форма иммунного ответа — противоопухолевый иммунитет .
В целом, существуют две ветви иммунного ответа, врожденная и адаптивная , которые работают вместе для защиты от патогенов. Обе ветви задействуют гуморальные и клеточные компоненты.
Врожденная ветвь — первая реакция организма на захватчика — известна как неспецифический и быстрый ответ на любой патоген. Компоненты врожденного иммунного ответа включают физические барьеры, такие как кожа и слизистые оболочки, иммунные клетки, такие как нейтрофилы , макрофаги и моноциты , и растворимые факторы, включая цитокины и комплемент . [2] С другой стороны, адаптивная ветвь — это иммунный ответ организма, который направлен против специфических антигенов , и, таким образом, требуется больше времени для активации вовлеченных компонентов. Адаптивная ветвь включает клетки, такие как дендритные клетки , Т-клетки и В-клетки , а также антитела , также известные как иммуноглобулины, которые напрямую взаимодействуют с антигеном и являются очень важным компонентом для сильного ответа против захватчика. [1]
Первый контакт организма с определенным антигеном приведет к образованию эффекторных Т- и В-клеток, которые являются активированными клетками, защищающими от патогена. Образование этих эффекторных клеток в результате первого воздействия называется первичным иммунным ответом. Клетки памяти Т и памяти В также производятся в случае, если тот же патоген снова попадает в организм. Если организм снова подвергается воздействию того же патогена, включится вторичный иммунный ответ, и иммунная система сможет отреагировать как быстро, так и сильно из-за клеток памяти от первого воздействия. [3] Вакцины вводят ослабленный, убитый или фрагментированный микроорганизм, чтобы вызвать первичный иммунный ответ. Это делается для того, чтобы в случае воздействия настоящего патогена организм мог полагаться на вторичный иммунный ответ, чтобы быстро защититься от него. [4]
Врожденный иммунный ответ — это первый ответ организма на чужеродных захватчиков. Этот иммунный ответ эволюционно сохраняется у многих различных видов, и все многоклеточные организмы имеют некоторую вариацию врожденного ответа. [5] Врожденная иммунная система состоит из физических барьеров, таких как кожа и слизистые оболочки , различных типов клеток, таких как нейтрофилы , макрофаги и моноциты , и растворимых факторов, включая цитокины и комплемент. [2] В отличие от адаптивного иммунного ответа , врожденный ответ не является специфическим для какого-либо одного чужеродного захватчика и, как следствие, быстро избавляет организм от патогенов. [ требуется ссылка ]
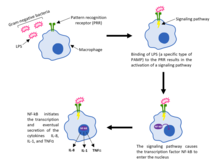
Патогены распознаются и обнаруживаются с помощью рецепторов распознавания образов (PRR). Эти рецепторы представляют собой структуры на поверхности макрофагов, которые способны связывать чужеродных захватчиков и, таким образом, инициировать клеточную сигнализацию внутри иммунной клетки. В частности, PRR идентифицируют патоген-ассоциированные молекулярные образцы (PAMP), которые являются неотъемлемыми структурными компонентами патогенов. Примерами PAMP являются пептидогликановая клеточная стенка или липополисахариды (LPS), оба из которых являются важными компонентами бактерий и, следовательно, эволюционно сохраняются во многих различных видах бактерий. [6]
Когда чужеродный патоген обходит физические барьеры и проникает в организм, PRR на макрофагах распознают и связываются с определенными PAMP. Это связывание приводит к активации сигнального пути , который позволяет фактору транскрипции NF-κB проникать в ядро макрофага и инициировать транскрипцию и последующую секрецию различных цитокинов, таких как IL-8 , IL-1 и TNFα . [5] Высвобождение этих цитокинов необходимо для проникновения нейтрофилов из кровеносных сосудов в инфицированную ткань. Как только нейтрофилы попадают в ткань, как и макрофаги, они способны фагоцитировать и убивать любые патогены или микробы. [ требуется цитата ]
Комплемент , еще один компонент врожденной иммунной системы, состоит из трех путей, которые активируются различными способами. Классический путь запускается, когда IgG или IgM связывается со своим целевым антигеном либо на мембране патогенной клетки, либо на антигенсвязанном антителе. Альтернативный путь активируется чужеродными поверхностями, такими как вирусы, грибки, бактерии, паразиты и т. д., и способен к самоактивации из-за «тиканья» C3. Лектиновый путь запускается, когда маннозосвязывающий лектин (MBL) или фиколин, также известный как специфические рецепторы распознавания образов, связываются с патоген-ассоциированными молекулярными образцами на поверхности вторгающихся микроорганизмов, таких как дрожжи , бактерии, паразиты и вирусы. [7] Каждый из трех путей гарантирует, что комплемент будет по-прежнему функционировать, если один путь перестанет работать или чужеродный захватчик сможет обойти один из этих путей ( принцип глубокоэшелонированной защиты ). [5] Хотя пути активируются по-разному, общая роль системы комплемента заключается в опсонизации патогенов и индуцировании серии воспалительных реакций , которые помогают бороться с инфекцией . [ необходима ссылка ]
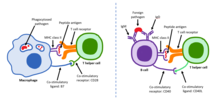
Адаптивный иммунный ответ — это вторая линия защиты организма . Клетки адаптивной иммунной системы чрезвычайно специфичны, поскольку на ранних стадиях развития В- и Т-клетки вырабатывают антигенные рецепторы, специфичные только для определенных антигенов . Это чрезвычайно важно для активации В- и Т-клеток. В- и Т-клетки — чрезвычайно опасные клетки, и если они способны атаковать, не подвергаясь строгому процессу активации, неисправная В- или Т-клетка может начать уничтожать собственные здоровые клетки хозяина. [8] Активация наивных хелперных Т-клеток происходит, когда антигенпрезентирующие клетки (АПК) представляют чужеродный антиген через молекулы MHC класса II на своей клеточной поверхности. Эти АПК включают дендритные клетки , В-клетки и макрофаги , которые специально оснащены не только MHC класса II, но и костимулирующими лигандами, которые распознаются костимулирующими рецепторами на хелперных Т-клетках. Без костимулирующих молекул адаптивный иммунный ответ был бы неэффективным, а Т-клетки стали бы анергичными . Несколько подгрупп Т-клеток могут быть активированы специфическими АПК, и каждая Т-клетка специально оснащена для борьбы с каждым уникальным микробным патогеном. Тип активированной Т-клетки и тип генерируемого ответа зависят, отчасти, от контекста, в котором АПК впервые столкнулась с антигеном. [9] После активации Т-хелперных клеток они способны активировать наивные В-клетки в лимфатическом узле . Однако активация В-клеток представляет собой двухэтапный процесс. Во-первых, рецепторы В-клеток, которые представляют собой просто антитела иммуноглобулина M (IgM) и иммуноглобулина D (IgD), специфичные для конкретной В-клетки, должны связаться с антигеном, что затем приводит к внутренней обработке, так что он представляется на молекулах MHC класса II В-клетки. Как только это происходит, Т-хелперная клетка, которая способна идентифицировать антиген, связанный с MHC, взаимодействует с ее костимулирующей молекулой и активирует В-клетку. В результате В-клетка становится плазматической клеткой , которая секретирует антитела, действующие как опсонин против захватчиков. [ необходима цитата ]
Специфичность в адаптивной ветви обусловлена тем, что каждая клетка B и T отличается. Таким образом, существует разнообразное сообщество клеток, готовых распознавать и атаковать полный спектр захватчиков. [8] Однако компромисс заключается в том, что адаптивный иммунный ответ намного медленнее врожденного ответа организма, поскольку его клетки чрезвычайно специфичны, и требуется активация, прежде чем он сможет фактически действовать. В дополнение к специфичности адаптивный иммунный ответ также известен иммунологической памятью . После столкновения с антигеном иммунная система вырабатывает клетки памяти T и B, которые обеспечивают более быстрый и надежный иммунный ответ в случае, если организм когда-либо снова столкнется с тем же антигеном. [8]

В зависимости от экзогенных требований различают несколько типов иммунного ответа (ИР). В этой парадигме иммунная система (как врожденная, так и адаптивная) и неиммунные клеточные и молекулярные компоненты организованы для оптимального реагирования на различные вызовы экспосом.
В настоящее время классифицируют несколько типов ИР. [10] [11]
ИР типа 1 вызывается вирусами, внутриклеточными бактериями, паразитами. Действующими лицами здесь являются врожденные лимфоидные клетки группы 1 (ILC1), NK-клетки, клетки Th1, макрофаги, опсонизирующие изотипы IgG.
ИР 2 типа вызывается токсинами и многоклеточными паразитами. Ключевыми игроками здесь являются ILC2, эпителиальные клетки , лимфоциты Th2, эозинофилы, базофилы, тучные клетки, IgE.
ИР типа 3 воздействует на внеклеточные бактерии и грибки, привлекая ILC3, Th17, нейтрофилы, опсонизирующие изотипы IgG.
Дополнительные типы ИР могут наблюдаться при неинфекционных патологиях. [12]
Все типы ИР имеют сенсорные (ILC, NK-клетки), адаптивные (T- и B-клетки) и эффекторные ( нейтрофилы , эозинофилы , базофилы , тучные клетки ) части. [11]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )[ нужна страница ]{{cite book}}: CS1 maint: местоположение отсутствует издатель ( ссылка ) CS1 maint: другие ( ссылка )[ нужна страница ]{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )[ нужна страница ]