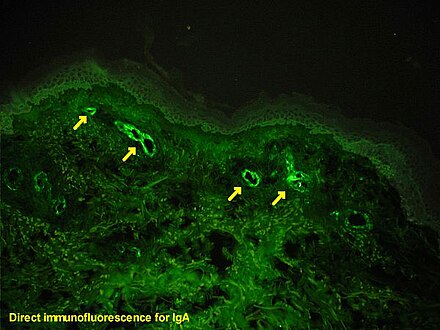

Иммунофлуоресценция — это метод световой микроскопии с помощью флуоресцентного микроскопа , который используется в основном для биологических образцов. Этот метод использует специфичность антител к их антигену для нацеливания флуоресцентных красителей на конкретные мишени биомолекул внутри клетки и, следовательно, позволяет визуализировать распределение целевой молекулы в образце. Специфическая область, которую антитело распознает на антигене, называется эпитопом . [1] Предпринимались попытки картирования эпитопов, поскольку многие антитела могут связывать один и тот же эпитоп, а уровни связывания между антителами, распознающими один и тот же эпитоп, могут различаться. [2] Кроме того, связывание флуорофора с самим антителом не может влиять на иммунологическую специфичность антитела или связывающую способность его антигена. [3] Иммунофлуоресценция является широко используемым примером иммуноокрашивания (с использованием антител для окрашивания белков) и конкретным примером иммуногистохимии (использование связи антитело-антиген в тканях). В этом методе в первую очередь используются флуорофоры для визуализации местоположения антител. [4]
Иммунофлуоресценцию можно использовать на срезах тканей, культивируемых клеточных линиях или отдельных клетках, а также для анализа распределения белков , гликанов и небольших биологических и небиологических молекул. Этот метод можно использовать даже для визуализации таких структур, как нити среднего размера. [5] Если топологию клеточной мембраны еще предстоит определить, вставку эпитопа в белки можно использовать в сочетании с иммунофлуоресценцией для определения структур. [6] Иммунофлуоресценцию также можно использовать в качестве «полуколичественного» метода для получения информации об уровнях и характере локализации метилирования ДНК, поскольку этот метод требует больше времени, чем истинные количественные методы, и существует некоторая субъективность в анализе уровни метилирования. [7] Иммунофлуоресценцию можно использовать в сочетании с другими методами флуоресцентного окрашивания, не использующими антитела, например, с использованием DAPI для мечения ДНК . Для анализа образцов иммунофлуоресценции можно использовать несколько конструкций микроскопов; Самый простой — эпифлуоресцентный микроскоп , также широко применяется конфокальный микроскоп . Также можно использовать различные конструкции микроскопов сверхвысокого разрешения , которые способны обеспечивать гораздо более высокое разрешение. [8]

Чтобы создать антитела, меченные флюорохромом, флуорохром должен быть конъюгирован («помечен») с антителом. Аналогично, антиген также можно конъюгировать с антителом с помощью флуоресцентного зонда методом, называемым методом флуоресцентного антигена. Процедуры окрашивания могут применяться как к фиксированному антигену в цитоплазме, так и к антигенам клеточной поверхности живых клеток, что называется «мембранной иммунофлуоресценцией». Также можно пометить комплемент комплекса антитело-антиген флуоресцентным зондом. Помимо элемента, к которому прикреплены флуоресцентные зонды, существует два основных класса методов иммунофлуоресценции: первичные и вторичные. Следующие описания будут сосредоточены главным образом на этих классах с точки зрения конъюгированных антител. [3]
Существует два класса методов иммунофлуоресценции: первичные (или прямые) и вторичные (или непрямые).
Первичная (прямая) иммунофлуоресценция использует одно первичное антитело, химически связанное с флуорофором . Первичное антитело распознает молекулу-мишень (антиген) и связывается со специфической областью, называемой эпитопом. Это достигается с помощью процесса, который манипулирует иммунным ответом организма с помощью адаптивного иммунитета. Прикрепленный флуорофор можно обнаружить с помощью флуоресцентной микроскопии, которая, в зависимости от используемого переносчика, при возбуждении излучает свет определенной длины волны. [9] Прямая иммунофлюоресценция, хотя и несколько менее распространена, имеет заметные преимущества перед вторичной (непрямой) процедурой. Прямое прикрепление мессенджера к антителу сокращает количество этапов процедуры, экономит время и снижает неспецифический фоновый сигнал. [10] Это также ограничивает возможность перекрестной реактивности антител и возможных ошибок на протяжении всего процесса. Однако у этого метода существуют некоторые недостатки. Поскольку количество флуоресцентных молекул, которые могут быть связаны с первичным антителом, ограничено, прямая иммунофлуоресценция существенно менее чувствительна, чем непрямая иммунофлуоресценция, и может привести к ложноотрицательным результатам. Прямая иммунофлуоресценция также требует использования гораздо большего количества первичных антител, что чрезвычайно дорого, иногда до 400 долларов США за мл.
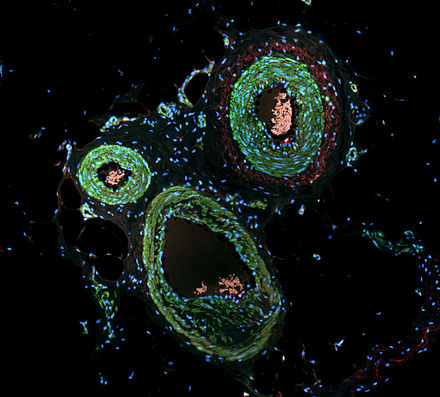

Вторичная (непрямая) иммунофлуоресценция использует два антитела; немеченое первое (первичное) антитело специфически связывает молекулу-мишень, а вторичное антитело, несущее флуорофор, распознает первичное антитело и связывается с ним. Несколько вторичных антител могут связывать одно первичное антитело. Это обеспечивает усиление сигнала за счет увеличения количества молекул флуорофора на антиген. [10] Этот протокол более сложен и требует больше времени, чем первичный (или прямой) протокол, описанный выше, но обеспечивает большую гибкость, поскольку для данного первичного антитела можно использовать множество различных вторичных антител и методов обнаружения. [10]
Этот протокол возможен, поскольку антитело состоит из двух частей: вариабельной области (которая распознает антиген) и константной области (составляющей структуру молекулы антитела). Важно осознавать, что это деление является искусственным и на самом деле молекула антитела представляет собой четыре полипептидные цепи: две тяжелые цепи и две легкие цепи. Исследователь может создать несколько первичных антител, которые распознают различные антигены (имеют разные вариабельные области), но все они имеют одну и ту же константную область. Таким образом, все эти антитела могут быть распознаны одним вторичным антителом. Это экономит затраты на модификацию первичных антител для непосредственного переноса флуорофора.
Различные первичные антитела с разными константными областями обычно генерируются путем выращивания антитела у разных видов. Например, исследователь может создать у козы первичные антитела, которые распознают несколько антигенов, а затем использовать связанные с красителем вторичные антитела кролика, которые распознают константную область антитела козла («антитела кролика против козы»). Затем исследователь может создать у мыши второй набор первичных антител, которые будут распознаваться отдельным вторичным антителом «ослиное антимышиное». Это позволяет повторно использовать трудноизготовляемые антитела, связанные с красителем, в нескольких экспериментах.
Как и в большинстве методов флуоресценции, серьезной проблемой при иммунофлуоресценции является фотообесцвечивание . Потерю активности, вызванную фотообесцвечиванием, можно контролировать путем уменьшения или ограничения интенсивности или продолжительности воздействия света, увеличения концентрации флуорофоров или использования более надежных флуорофоров, менее склонных к обесцвечиванию (например, Alexa Fluors , Seta Fluors). или DyLight Fluors ). Некоторые проблемы, которые могут возникнуть при использовании этого метода, включают автофлуоресценцию, постороннюю нежелательную специфическую флуоресценцию и неспецифическую флуоресценцию. Автофлуоресценция включает флуоресценцию, излучаемую тканью образца или самой клеткой. Посторонняя нежелательная специфическая флуоресценция возникает, когда целевой антиген является нечистым и содержит антигенные примеси. Неспецифическая флуоресценция предполагает потерю специфичности зонда из-за флуорофора, неправильной фиксации или высыхания образца. [3]
Иммунофлуоресценция ограничивается только фиксированными (т.е. мертвыми) клетками, когда необходимо визуализировать структуры внутри клетки, поскольку антитела не проникают через клеточную мембрану при реакции с флуоресцентными метками. Антигенный материал должен прочно фиксироваться на месте его естественной локализации внутри клетки. [3] Интактные антитела также могут быть слишком большими, чтобы окрашивать раковые клетки in vivo . [12] Их размер приводит к медленному проникновению в опухоль и длительному периоду полувыведения из крови. Было проведено исследование по изучению использования диател, чтобы обойти это ограничение. [12] Белки в супернатанте или снаружи клеточной мембраны могут связываться антителами; это позволяет окрашивать живые клетки. В зависимости от используемого фиксатора интересующие белки могут стать сшитыми, что может привести к ложноположительным или ложноотрицательным сигналам из-за неспецифического связывания.
Альтернативный подход заключается в использовании рекомбинантных белков , содержащих домены флуоресцентных белков, например, зеленого флуоресцентного белка (GFP). Использование таких «меченых» белков позволяет определить их локализацию в живых клетках. Несмотря на то, что это кажется элегантной альтернативой иммунофлуоресценции, клетки необходимо трансфицировать или трансдуцировать с помощью GFP-метки, и, как следствие, они становятся организмами как минимум S1 или выше, которые требуют более строгих стандартов безопасности в лаборатории. Этот метод предполагает изменение генетической информации клеток. [13]
Многие усовершенствования этого метода связаны с усовершенствованием флуоресцентных микроскопов и флуорофоров. Методы сверхвысокого разрешения обычно относятся к способности микроскопа обеспечивать разрешение ниже предела Аббе (предел, налагаемый на свет из-за его длины волны). Этот дифракционный предел составляет около 200-300 нм в латеральном направлении и 500-700 нм в аксиальном направлении. Этот предел сопоставим или больше, чем у некоторых структур в клетке, и, следовательно, этот предел не позволял ученым определять детали их структуры. [14] Сверхразрешение флуоресценции, в частности, относится к способности микроскопа предотвращать одновременную флуоресценцию соседних спектрально идентичных флуорофоров. [15] Этот процесс эффективно улучшает функцию рассеяния точки микроскопа. [14] Примеры недавно разработанных методов флуоресцентной микроскопии сверхвысокого разрешения включают микроскопию с истощением стимулированного излучения (STED), микроскопию с насыщенным структурированным освещением (SSIM), флуоресцентную фотоактивационную локализационную микроскопию (FPALM) и микроскопию стохастической оптической реконструкции (STORM). [16]