Хлорид трис(бипиридин)рутения(II) представляет собой координационный комплекс хлоридной соли с формулой [Ru(bpy) 3 ]Cl 2 . Этот полипиридиновый комплекс представляет собой красную кристаллическую соль, полученную в виде гексагидрата , хотя все интересующие свойства находятся в катионе [ Ru(bpy) 3 ] 2+ , который привлек большое внимание из-за своих отличительных оптических свойств. Хлориды могут быть заменены другими анионами , такими как PF 6 − .

Эта соль получается путем обработки водного раствора трихлорида рутения 2,2'-бипиридином . В этом преобразовании Ru(III) восстанавливается до Ru(II), и фосфорноватистая кислота обычно добавляется в качестве восстановителя. [1] [Ru(bpy) 3 ] 2+ является октаэдрическим, содержащим центральный низкоспиновый d 6 Ru(II)-ион и три бидентатных лиганда bpy. Расстояния Ru-N составляют 2,053(2), что короче расстояний Ru-N для [Ru(bpy) 3 ] 3+ . [2] Комплекс является хиральным с симметрией D 3 . Он был разделен на свои энантиомеры . В своем самом низком триплетном возбужденном состоянии молекула, как полагают, достигает более низкой симметрии C 2 , поскольку возбужденный электрон локализован в основном на одном бипиридильном лиганде. [3] [4]
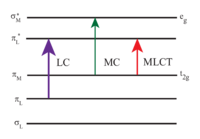
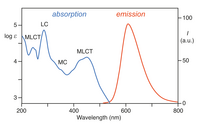
[Ru(bpy) 3 ] 2+ поглощает ультрафиолетовый и видимый свет. Водные растворы [Ru(bpy) 3 ]Cl 2 имеют оранжевый цвет из-за сильного поглощения MLCT при 452 ± 3 нм ( коэффициент экстинкции 14 600 М −1 см −1 ). Дополнительные полосы поглощения обнаружены при 285 нм, что соответствует лиганд-центрированным π * ← π переходам и слабому переходу около 350 нм (dd переход). [5] Поглощение света приводит к образованию возбужденного состояния, имеющего относительно большое время жизни 890 нс в ацетонитриле [6] и 650 нс в воде. [6] Возбужденное состояние релаксирует в основное состояние путем испускания фотона или безызлучательной релаксации. Квантовый выход составляет 2,8% в воде, насыщенной воздухом, при 298 К, а максимальная длина волны испускания составляет 620 нм. [7] Длительное время жизни возбужденного состояния объясняется тем, что оно является триплетным , тогда как основное состояние является синглетным , и отчасти тем, что структура молекулы допускает разделение зарядов. Переходы синглет-триплет запрещены и поэтому часто медленные .
Как и все молекулярные возбужденные состояния, триплетное возбужденное состояние [Ru(bpy) 3 ] 2+ имеет как более сильные окислительные, так и восстановительные свойства, чем его основное состояние. Такая ситуация возникает, поскольку возбужденное состояние можно описать как комплекс Ru 3+ , содержащий радикальный анион bpy •− в качестве лиганда. Таким образом, фотохимические свойства [Ru(bpy) 3 ] 2+ напоминают фотосинтетическую сборку , которая также включает разделение электрона и дырки . [ 8]
[Ru(bpy) 3 ] 2+ был исследован как фотосенсибилизатор как для окисления, так и для восстановления воды. При поглощении фотона [Ru(bpy) 3 ] 2+ преобразуется в вышеупомянутое триплетное состояние, обозначенное [Ru(bpy) 3 ] 2+ *. Этот вид переносит электрон, расположенный на одном лиганде bpy, на жертвенный окислитель, такой как пероксодисульфат (S 2 O 8 2− ). Полученный [Ru(bpy) 3 ] 3+ является мощным окислителем и окисляет воду до O 2 и протонов с помощью катализатора . [9] В качестве альтернативы восстановительная способность [Ru(bpy) 3 ] 2+ * может быть использована для восстановления метилвиологена , перерабатываемого переносчика электронов, который, в свою очередь, восстанавливает протоны на платиновом катализаторе. Чтобы этот процесс был каталитическим, вводится жертвенный восстановитель, такой как ЭДТА 4− или триэтаноламин , который возвращает Ru(III) обратно в Ru(II).
Производные [Ru(bpy) 3 ] 2+ многочисленны. [10] [11] Такие комплексы широко обсуждаются для применения в биодиагностике, фотовольтаике и органических светодиодах , но ни одно производное не было коммерциализировано. Применение [Ru(bpy) 3 ] 2+ и его производных для изготовления оптических химических сенсоров, возможно, является одной из самых успешных областей на сегодняшний день. [12]
Фотоокислительно-восстановительный катализ использует [Ru(bpy) 3 ] 2+ как сенсибилизатор в качестве стратегии для органического синтеза. Многие аналоги [Ru(bpy) 3 ] 2+ также используются. Эти преобразования используют окислительно-восстановительные свойства [Ru(bpy) 3 ] 2+ * и его восстановительно погашенного производного [Ru(bpy) 3 ] + . [13] [14] [15] [16]
Металлический бипиридин, а также родственные ему фенантролиновые комплексы, как правило, биоактивны, поскольку могут действовать как интеркалирующие агенты .
{{cite book}}: CS1 maint: местоположение ( ссылка ){{cite book}}: |journal=проигнорировано ( помощь )