Генная конверсия — это процесс, при котором одна последовательность ДНК заменяет гомологичную последовательность таким образом, что последовательности становятся идентичными после события конверсии. Генная конверсия может быть либо аллельной , что означает, что один аллель того же гена заменяет другой аллель, либо эктопической , что означает, что одна паралогичная последовательность ДНК преобразует другую.
Конверсия аллельных генов происходит во время мейоза , когда гомологичная рекомбинация между гетерозиготными участками приводит к несоответствию в спаривании оснований. Это несоответствие затем распознается и корректируется клеточным механизмом, заставляя один из аллелей преобразовываться в другой. Это может вызвать неменделевскую сегрегацию аллелей в зародышевых клетках. [1]
Рекомбинация происходит не только во время мейоза, но и как механизм восстановления двухцепочечных разрывов (DSB), вызванных повреждением ДНК. Эти DSB обычно восстанавливаются с использованием сестринской хроматиды разорванного дуплекса, а не гомологичной хромосомы, поэтому они не приводят к аллельной конверсии. Рекомбинация также происходит между гомологичными последовательностями, присутствующими в разных геномных локусах (паралогичные последовательности), которые возникли в результате предыдущих дупликаций генов. Генная конверсия, происходящая между паралогичными последовательностями ( эктопическая генная конверсия ), предположительно ответственна за согласованную эволюцию семейств генов. [1] [2] [3]
Преобразование одного аллеля в другой часто происходит из-за исправления несоответствия оснований во время гомологичной рекомбинации : если одна из четырех хроматид во время мейоза образует пару с другой хроматидой, что может произойти из-за гомологии последовательностей , может произойти перенос цепи ДНК с последующим исправлением несоответствия. Это может изменить последовательность одной из хромосом, так что она станет идентичной другой.
Мейотическая рекомбинация инициируется посредством образования двухцепочечного разрыва (DSB). Затем 5'-концы разрыва деградируют, оставляя длинные 3'-выступы из нескольких сотен нуклеотидов. Затем один из этих 3'-одноцепочечных сегментов ДНК вторгается в гомологичную последовательность на гомологичной хромосоме, образуя промежуточное соединение, которое может быть восстановлено различными путями, приводящими либо к кроссоверам (CO), либо к некроссоверам (NCO). На различных этапах процесса рекомбинации образуется гетеродуплексная ДНК (двуцепочечная ДНК, состоящая из одиночных нитей от каждой из двух гомологичных хромосом, которые могут быть или не быть идеально комплементарными). Когда в гетеродуплексной ДНК возникают несоответствия, последовательность одной нити будет восстановлена, чтобы связать другую нить с идеальной комплементарностью, что приведет к преобразованию одной последовательности в другую. Этот процесс восстановления может следовать одному из двух альтернативных путей, как показано на рисунке. По одному пути образуется структура, называемая двойным соединением Холлидея (DHJ), что приводит к обмену цепями ДНК. По другому пути, называемому отжигом цепей, зависящим от синтеза (SDSA), происходит обмен информацией, но не физический обмен. Генная конверсия произойдет во время SDSA, если две молекулы ДНК гетерозиготны в месте рекомбинационной репарации. Генная конверсия может также происходить во время рекомбинационной репарации с участием DHJ, и эта генная конверсия может быть связана с физической рекомбинацией дуплексов ДНК по обе стороны DHJ.
Смещенная генная конверсия (BGC) происходит, когда один аллель имеет более высокую вероятность быть донором, чем другой в событии генной конверсии. Например, когда происходит несоответствие T:G, оно с большей или меньшей вероятностью будет исправлено на пару C:G, чем на пару T:A. Это дает этому аллелю более высокую вероятность передачи следующему поколению. Несмещенная генная конверсия означает, что обе возможности происходят с равной вероятностью.
Конверсия генов с GC-смещением (gBGC) — это процесс, при котором содержание GC в ДНК увеличивается из-за конверсии генов во время рекомбинации. [2] Доказательства существования gBGC существуют для дрожжей и людей, и эта теория недавно была проверена на других эукариотических линиях. [4] В проанализированных последовательностях человеческой ДНК было обнаружено, что скорость кроссинговера положительно коррелирует с содержанием GC. [2] Псевдоаутосомные регионы (PAR) хромосом X и Y у людей, которые, как известно, имеют высокие показатели рекомбинации, также имеют высокое содержание GC. [1] Некоторые гены млекопитающих, претерпевающие согласованную эволюцию (например, рибосомные опероны, тРНК и гены гистонов), очень богаты GC. [1] Было показано, что содержание GC выше в паралогичных генах гистонов человека и мыши, которые являются членами больших подсемейств (предположительно, претерпевающих согласованную эволюцию), чем в паралогичных генах гистонов с относительно уникальными последовательностями. [5] Также имеются данные о смещении GC в процессе репарации ошибочных спаренных оснований. [1] Предполагается, что это может быть адаптацией к высокой скорости дезаминирования метилцитозина, которая может приводить к переходам C→T.
Ген Fxy или Mid1 у некоторых млекопитающих, тесно связанных с домовыми мышами (люди, крысы и другие виды Mus), расположен в сцепленной с полом области Х-хромосомы. Однако у Mus musculus он недавно транслоцировался таким образом, что 3'-конец гена перекрывается с областью PAR Х-хромосомы, которая, как известно, является горячей точкой рекомбинации. Эта часть гена испытала резкое увеличение содержания GC и скорости замены в 3-й позиции кодона, а также в интронах, но 5'-область гена, которая является сцепленной с Х-хромосомой, этого не сделала. Поскольку этот эффект присутствует только в области гена, испытывающей повышенную скорость рекомбинации, он должен быть вызван смещенной генной конверсией, а не селективным давлением. [2]
Содержание GC в геноме человека сильно варьируется (40–80%), но, по-видимому, существуют большие участки генома, где содержание GC в среднем выше или ниже, чем в других регионах. [1] Эти регионы, хотя и не всегда имеют четкие границы, известны как изохоры. Одним из возможных объяснений наличия изохор, богатых GC, является то, что они эволюционировали из-за конверсии генов со смещением в сторону GC в регионах с высоким уровнем рекомбинации.
Исследования генной конверсии внесли вклад в наше понимание адаптивной функции мейотической рекомбинации. Обычный паттерн сегрегации пары аллелей (Aa) среди 4 продуктов мейоза — 2A:2a. Обнаружение нечастых событий генной конверсии (например, паттернов сегрегации 3:1 или 1:3 во время отдельных мейозов) дает представление об альтернативных путях рекомбинации, приводящих либо к кроссоверным, либо к некроссоверным хромосомам. Считается, что события генной конверсии возникают там, где аллели «A» и «a» оказываются вблизи точного местоположения события молекулярной рекомбинации. Таким образом, можно измерить частоту, с которой события генной конверсии связаны с кроссинговером или некроссинговером хромосомных областей, прилегающих к непосредственному событию конверсии, но находящихся за его пределами. Были проведены многочисленные исследования генной конверсии у различных грибов (которые особенно подходят для таких исследований), и результаты этих исследований были рассмотрены Уайтхаусом. [6] Из этого обзора ясно, что большинство событий генной конверсии не связаны с внешним обменом маркерами. Таким образом, большинство событий генной конверсии в нескольких различных изученных грибах связаны с некроссинговером внешних маркеров. События генной конверсии без кроссинговера в основном производятся с помощью синтез-зависимого отжига цепи (SDSA). [7] Этот процесс включает ограниченный информационный обмен, но не физический обмен ДНК между двумя участвующими гомологичными хромосомами в месте события конверсии, и производится мало генетических вариаций. Таким образом, объяснения адаптивной функции мейотической рекомбинации, которые сосредоточены исключительно на адаптивной выгоде создания новой генетической вариации или физического обмена, кажутся недостаточными для объяснения большинства событий рекомбинации во время мейоза. Однако большинство событий мейотической рекомбинации можно объяснить предположением, что они являются адаптацией для восстановления повреждений в ДНК, которые должны быть переданы гаметам. [8]
Особый интерес, с точки зрения того, что рекомбинация является адаптацией для восстановления ДНК, представляют исследования на дрожжах, показывающие, что конверсия генов в митотических клетках усиливается под действием УФ-излучения [9] [10] и ионизирующего излучения [11].
В обсуждениях генетических заболеваний у людей, псевдоген- опосредованные генные конверсии, которые вносят патогенные мутации в функциональные гены, являются хорошо известным механизмом мутации. Напротив, возможно, что псевдогены могут служить шаблонами. В ходе эволюции функциональные исходные гены, которые потенциально выгодны, были получены из множественных копий в их единственном исходном гене. Изменения, шаблонные псевдогеном, могут в конечном итоге стать фиксированными, если они не обладают пагубными эффектами. [12] Таким образом, на самом деле, псевдогены могут выступать в качестве источников вариантов последовательностей, которые могут быть переданы функциональным генам в новых комбинациях и на которые можно воздействовать путем отбора . Лектин 11 ( SIGLEC 11), человеческий иммуноглобулин, который связывается с сиаловой кислотой, можно считать примером такого события генной конверсии, которое сыграло значительную роль в эволюции. При сравнении гомологичных генов человеческого SIGLEC11 и его псевдогена у шимпанзе , гориллы и орангутана , по-видимому, произошла генная конверсия последовательности 5'-восходящих областей и экзонов, кодирующих домен распознавания сиаловой кислоты, примерно в 2 кбн от близко расположенного псевдогена hSIGLECP16 (Hayakawa et al., 2005). Три доказательства, касающиеся этого события, в совокупности предполагают, что это адаптивное изменение, которое очень важно с эволюционной точки зрения для рода Homo . Они включают в себя то, что только в человеческой линии произошла эта генная конверсия, кора головного мозга приобрела важную экспрессию SIGLEC11, особенно в человеческой линии, и проявление изменения в связывании субстрата в человеческой линии по сравнению с его аналогом у шимпанзе. Конечно, частота вклада этого механизма генной конверсии, опосредованного псевдогеном, в функциональные и адаптивные изменения в эволюции человека до сих пор неизвестна и до сих пор она была едва изучена. [13] Несмотря на это, введение позитивно селективных генетических изменений таким механизмом может быть предложено для рассмотрения на примере SIGLEC11. Иногда из-за вмешательства мобильных элементов в некоторых членов семейства генов, это вызывает вариацию среди них и, в конечном итоге, это может также остановить скорость генной конверсии из-за отсутствия сходства последовательностей, что приводит к дивергентной эволюции .
Из различных анализов генома был сделан вывод, что двухцепочечные разрывы (DSB) могут быть восстановлены посредством гомологичной рекомбинации по крайней мере двумя различными, но связанными путями. [12] В случае основного пути будут использоваться гомологичные последовательности с обеих сторон DSB, что, по-видимому, аналогично консервативной модели восстановления DSB [14] , которая была первоначально предложена для мейотической рекомбинации у дрожжей. [15] тогда как второстепенный путь ограничен только одной стороной DSB, как постулируется неконсервативной односторонней моделью вторжения. [16] Однако в обоих случаях последовательность партнеров по рекомбинации будет абсолютно сохранена. В силу своей высокой степени гомологии новые копии генов, которые появились после дупликации гена, естественно, имеют тенденцию либо к неравному кроссоверу, либо к однонаправленным событиям генной конверсии. В последнем процессе существуют последовательности акцептора и донора, и последовательность акцептора будет заменена последовательностью, скопированной с донора, в то время как последовательность донора останется неизменной. [13]
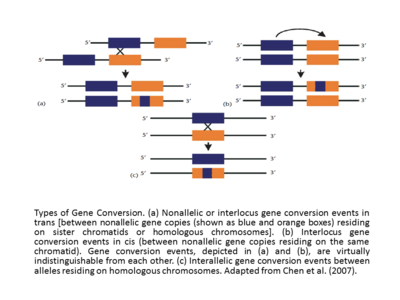
Эффективная гомология между взаимодействующими последовательностями делает событие генной конверсии успешным. Кроме того, частота генной конверсии обратно пропорциональна расстоянию между взаимодействующими последовательностями в цис, [17] [12] , а скорость генной конверсии обычно прямо пропорциональна длине непрерывного тракта последовательности в предполагаемой преобразованной области. Кажется, что конверсионные тракты, сопровождающие кроссинговер, длиннее (средняя длина = ~460 п.н.), чем конверсионные тракты без кроссинговер (средняя длина = 55–290 п.н.). [18] В исследованиях генов глобулина человека долгое время поддерживалось мнение, что событие генной конверсии или события миграции ветвей могут либо стимулироваться, либо подавляться специфическими мотивами, которые существуют поблизости от последовательности ДНК (Papadakis and Patrinos, 1999). [12] Другая базовая классификация событий генной конверсии — это интерлокусные (также называемые неаллельными) и межаллельные конверсии генов. События цис- или транс-неаллельной или интерлокусной генной конверсии происходят между неаллельными копиями генов, находящимися на сестринских хроматидах или гомологичных хромосомах, а в случае интераллельной генной конверсии события генной конверсии происходят между аллелями, находящимися на гомологичных хромосомах (адаптировано из Chen et al., (2007) [13] [12] Если сравнивать события интерлокусной генной конверсии, часто обнаруживается, что они демонстрируют смещенную направленность. Иногда, как в случае генов глобина человека (Papadakis and Patrinos, 1999), [12] направление генной конверсии коррелирует с относительными уровнями экспрессии генов, участвующих в событии, при этом ген, экспрессируемый на более высоком уровне, называется «главным» геном, преобразует тот, который экспрессируется на более низком уровне, называется «подчиненным» геном. Первоначально сформулированное в эволюционном контексте, правило «главного/подчиненного гена» следует объяснять с осторожностью. Фактически, увеличение транскрипции гена демонстрирует не только увеличение вероятности его использования в качестве донора, но и в качестве акцептора. [12] [19]
Обычно организм, унаследовавший разные копии гена от каждого из своих родителей, называется гетерозиготным. Это обобщенно представлено как генотип: Aa (т. е. одна копия варианта ( аллеля ) 'A' и одна копия аллеля 'a'). Когда гетерозигота создает гаметы путем мейоза , аллели обычно дуплицируются и оказываются в соотношении 2:2 в полученных 4 клетках, которые являются прямыми продуктами мейоза. Однако при генной конверсии наблюдается соотношение, отличное от ожидаемого 2A:2a, в котором A и a являются двумя аллелями. Примерами являются 3A:1a и 1A:3a. Другими словами, может быть, например, в три раза больше аллелей A, чем аллелей a, экспрессируемых в дочерних клетках, как в случае 3A:1a.
Генная конверсия, приводящая к мутации гена CYP21A2 , является распространенной генетической причиной врожденной гиперплазии надпочечников . Соматическая генная конверсия является одним из механизмов, которые могут привести к семейной ретинобластоме , врожденному раку сетчатки , и предполагается, что генная конверсия может играть роль в развитии болезни Хантингтона .