Кооперативное связывание происходит в молекулярных системах связывания , содержащих более одного типа или вида молекулы, и в которых один из партнеров не является моновалентным и может связывать более одной молекулы другого вида. В общем, молекулярное связывание представляет собой взаимодействие между молекулами, которое приводит к стабильной физической ассоциации между этими молекулами.
Кооперативное связывание происходит в молекулярной системе связывания, где две или более молекул лиганда могут связываться с молекулой рецептора . Связывание можно считать «кооперативным», если фактическое связывание первой молекулы лиганда с рецептором изменяет сродство связывания второй молекулы лиганда. Связывание молекул лиганда с различными участками на молекуле рецептора не является взаимно независимыми событиями. Кооперативность может быть положительной или отрицательной, что означает, что становится более или менее вероятным, что последующие молекулы лиганда будут связываться с молекулой рецептора.
Кооперативное связывание наблюдается во многих биополимерах, включая белки и нуклеиновые кислоты . Было показано, что кооперативное связывание является механизмом, лежащим в основе большого спектра биохимических и физиологических процессов.
В 1904 году Кристиан Бор изучал связывание гемоглобина с кислородом при различных условиях. [1] [2] При построении графика насыщения гемоглобина кислородом в зависимости от парциального давления кислорода он получил сигмоидальную (или «S-образную») кривую. Это указывает на то, что чем больше кислорода связано с гемоглобином, тем легче большему количеству кислорода связываться — до тех пор, пока все места связывания не будут насыщены. Кроме того, Бор заметил, что увеличение давления CO2 смещает эту кривую вправо — т. е. более высокие концентрации CO2 затрудняют связывание гемоглобина с кислородом. [2] Это последнее явление, вместе с наблюдением, что сродство гемоглобина к кислороду увеличивается с ростом pH, известно как эффект Бора .

Говорят, что молекула рецептора проявляет кооперативное связывание, если ее связывание с лигандом масштабируется нелинейно с концентрацией лиганда. Кооперативность может быть положительной (если связывание молекулы лиганда увеличивает кажущееся сродство рецептора и, следовательно, увеличивает вероятность связывания другой молекулы лиганда) или отрицательной (если связывание молекулы лиганда уменьшает сродство и, следовательно, делает связывание других молекул лиганда менее вероятным). «Фракционная занятость» рецептора данным лигандом определяется как количество связанных с лигандом участков связывания, деленное на общее количество участков связывания лиганда:
Если , то белок полностью не связан, а если , то он полностью насыщен. Если график при равновесии как функция концентрации лиганда имеет сигмоидальную форму, как это наблюдал Бор для гемоглобина, это указывает на положительную кооперативность. Если это не так, то нельзя сделать никаких утверждений о кооперативности, глядя только на этот график.
Концепция кооперативного связывания применима только к молекулам или комплексам с более чем одним сайтом связывания лиганда. Если существует несколько сайтов связывания лиганда, но связывание лиганда с любым сайтом не влияет на другие, рецептор называется некооперативным. Кооперативность может быть гомотропной , если лиганд влияет на связывание лигандов того же вида, или гетеротропной , если он влияет на связывание других видов лигандов. В случае гемоглобина Бор наблюдал гомотропную положительную кооперативность (связывание кислорода способствует связыванию большего количества кислорода) и гетеротропную отрицательную кооперативность (связывание CO2 снижает способность гемоглобина связывать кислород).
На протяжении 20-го века были разработаны различные структуры для описания связывания лиганда с белком с более чем одним сайтом связывания и кооперативных эффектов, наблюдаемых в этом контексте. [3]
Первое описание кооперативного связывания с многосайтовым белком было разработано А. В. Хиллом . [4] Опираясь на наблюдения за связыванием кислорода с гемоглобином и идею о том, что кооперативность возникает из-за агрегации молекул гемоглобина, каждая из которых связывает одну молекулу кислорода, Хилл предложил феноменологическое уравнение, которое с тех пор было названо в его честь :

где — «коэффициент Хилла», обозначает концентрацию лиганда, обозначает кажущуюся константу ассоциации (используется в исходной форме уравнения), — эмпирическая константа диссоциации, а — микроскопическая константа диссоциации (используется в современных формах уравнения и эквивалентна ). Если , система проявляет отрицательную кооперативность, тогда как кооперативность положительна, если . Общее число мест связывания лиганда является верхней границей для . Уравнение Хилла можно линеаризировать следующим образом:
«График Хилла» получается путем построения графика зависимости от . В случае уравнения Хилла это линия с наклоном и отсекаемым отрезком . Это означает, что кооперативность предполагается фиксированной, т. е. она не меняется с насыщением. Это также означает, что сайты связывания всегда демонстрируют одинаковое сродство, и кооперативность не возникает из-за сродства, увеличивающегося с концентрацией лиганда.
GS Adair обнаружил, что график Хилла для гемоглобина не является прямой линией, и выдвинул гипотезу, что связывающее сродство не является фиксированным термином, а зависит от насыщения лиганда. [5] Продемонстрировав, что гемоглобин содержит четыре гема (и, следовательно, места связывания для кислорода), он исходил из предположения, что полностью насыщенный гемоглобин образуется поэтапно, с промежуточными формами с одной, двумя или тремя связанными молекулами кислорода. Образование каждой промежуточной стадии из несвязанного гемоглобина можно описать с помощью кажущейся макроскопической константы ассоциации . Результирующее дробное заполнение можно выразить как:
Или для любого белка с n сайтами связывания лиганда:
где n обозначает число сайтов связывания, а каждый из них является комбинированной константой ассоциации, описывающей связывание i молекул лиганда. Объединяя обработку Адэра с графиком Хилла, можно прийти к современному экспериментальному определению кооперативности (Хилл, 1985, Абелиович, 2005). Результирующий коэффициент Хилла или, точнее, наклон графика Хилла, рассчитанный по уравнению Адэра, может быть показан как отношение дисперсии числа связывания к дисперсии числа связывания в эквивалентной системе невзаимодействующих сайтов связывания. [6] Таким образом, коэффициент Хилла определяет кооперативность как статистическую зависимость одного сайта связывания от состояния другого сайта(ов).
Работая над кальцийсвязывающими белками, Ирвинг Клотц деконволюционировал константы ассоциации Адайра, рассмотрев поэтапное образование промежуточных стадий, и попытался выразить кооперативное связывание в терминах элементарных процессов, управляемых законом действующих масс. [7] [8] В его рамках — это константа ассоциации, управляющая связыванием первой молекулы лиганда, константа ассоциации, управляющая связыванием второй молекулы лиганда (когда первая уже связана) и т. д. Для это дает:
Стоит отметить, что константы , и т. д. не относятся к отдельным сайтам связывания. Они описывают, сколько сайтов связывания занято, а не какие именно . Эта форма имеет то преимущество, что кооперативность легко распознается при рассмотрении констант ассоциации. Если все сайты связывания лиганда идентичны с микроскопической константой ассоциации , можно было бы ожидать (то есть ) при отсутствии кооперативности. Мы имеем положительную кооперативность, если лежит выше этих ожидаемых значений для .
Уравнение Клотца (которое иногда также называют уравнением Адайра-Клотца) до сих пор часто используется в экспериментальной литературе для описания измерений связывания лиганда в терминах последовательных кажущихся констант связывания. [9]
К середине 20-го века возрос интерес к моделям, которые не только описывали бы кривые связывания феноменологически, но и предлагали бы лежащий в их основе биохимический механизм. Лайнус Полинг переосмыслил уравнение, предоставленное Адэром, предположив, что его константы были комбинацией константы связывания для лиганда ( в уравнении ниже) и энергии, поступающей от взаимодействия между субъединицами кооперативного белка ( ниже). [10] Полинг фактически вывел несколько уравнений, в зависимости от степени взаимодействия между субъединицами. Основываясь на неверных предположениях о локализации гемов, он выбрал неправильное уравнение для описания связывания кислорода гемоглобином, предположив, что субъединицы расположены в квадрате. Уравнение ниже представляет собой уравнение для тетраэдрической структуры, которое было бы более точным в случае гемоглобина:
Основываясь на результатах, показывающих, что структура кооперативных белков изменяется при связывании с их лигандом, Дэниел Кошланд и коллеги [11] уточнили биохимическое объяснение механизма, описанного Полингом. [10] Модель Кошланда-Немети-Филмера (KNF) предполагает, что каждая субъединица может существовать в одной из двух конформаций: активной или неактивной. Связывание лиганда с одной субъединицей вызовет немедленное конформационное изменение этой субъединицы из неактивной в активную конформацию, механизм, описанный как «индуцированное соответствие». [12] Кооперативность, согласно модели KNF, возникает из-за взаимодействий между субъединицами, сила которых варьируется в зависимости от относительных конформаций вовлеченных субъединиц. Для тетраэдрической структуры (они также рассматривали линейные и квадратные структуры) они предложили следующую формулу:
Где — константа ассоциации для X, — отношение состояний B и A в отсутствие лиганда («переход»), а — относительные стабильности пар соседних субъединиц по сравнению с парой, в которой обе субъединицы находятся в состоянии A (обратите внимание, что в статье KNF фактически представлено число занятых участков, которое здесь умножено на 4 ).


Модель Моно-Ваймана-Шанжо (MWC) для согласованных аллостерических переходов [13] пошла на шаг дальше, исследуя кооперативность на основе термодинамики и трехмерных конформаций. Первоначально она была сформулирована для олигомерных белков с симметрично расположенными идентичными субъединицами, каждая из которых имеет один сайт связывания лиганда. Согласно этой структуре, два (или более) взаимопревращаемых конформационных состояния аллостерического белка сосуществуют в тепловом равновесии. Состояния, часто называемые напряженными (T) и расслабленными (R), различаются по сродству к молекуле лиганда. Соотношение между двумя состояниями регулируется связыванием молекул лиганда, которое стабилизирует состояние с более высоким сродством. Важно, что все субъединицы молекулы изменяют состояния одновременно, явление, известное как «согласованный переход».
Константа аллостерической изомеризации L описывает равновесие между обоими состояниями, когда не связана ни одна молекула лиганда: . Если L очень велико, большая часть белка находится в состоянии T в отсутствие лиганда. Если L мало (близко к единице), состояние R почти так же заселено, как и состояние T. Отношение констант диссоциации лиганда из состояний T и R описывается константой c : . Если , то оба состояния R и T имеют одинаковое сродство к лиганду, и лиганд не влияет на изомеризацию. Значение c также указывает, насколько сильно изменяется равновесие между состояниями T и R при связывании лиганда: чем меньше c , тем больше равновесие смещается в сторону состояния R после одного связывания. При дробная заселенность описывается как:
Сигмоидальный график Хилла аллостерических белков затем может быть проанализирован как прогрессивный переход от состояния T (низкое сродство) к состоянию R (высокое сродство) по мере увеличения насыщения. Наклон графика Хилла также зависит от насыщения, с максимальным значением в точке перегиба. Пересечения между двумя асимптотами и осью Y позволяют определить сродство обоих состояний к лиганду.

В белках конформационные изменения часто связаны с активностью или активностью по отношению к определенным целям. Такая активность часто является физиологически значимой или экспериментально измеряемой. Степень конформационных изменений описывается функцией состояния , которая обозначает долю белка, присутствующего в состоянии. Как показывает энергетическая диаграмма, увеличивается по мере связывания большего количества молекул лиганда. Выражение для имеет вид:
Важнейшим аспектом модели MWC является то, что кривые для и не совпадают, [14] т.е. фракционное насыщение не является прямым индикатором конформационного состояния (и, следовательно, активности). Более того, степени кооперативности связывания и кооперативности активации могут быть очень разными: экстремальный случай обеспечивается жгутиковым двигателем бактерий с коэффициентом Хилла 1,7 для связывания и 10,3 для активации. [15] [16] Сверхлинейность ответа иногда называют сверхчувствительностью .
Если аллостерический белок связывается с мишенью, которая также имеет более высокое сродство к состоянию R, то связывание с мишенью дополнительно стабилизирует состояние R, тем самым увеличивая сродство лиганда. Если, с другой стороны, мишень преимущественно связывается с состоянием T, то связывание с мишенью будет иметь отрицательный эффект на сродство лиганда. Такие мишени называются аллостерическими модуляторами .
С момента своего создания структура MWC была расширена и обобщена. Были предложены вариации, например, для обслуживания белков с более чем двумя состояниями, [17] белков, которые связываются с несколькими типами лигандов [18] [19] или несколькими типами аллостерических модуляторов [19] и белков с неидентичными субъединицами или сайтами связывания лигандов. [20]
Список молекулярных ансамблей, демонстрирующих кооперативное связывание лигандов, очень велик, но некоторые примеры особенно примечательны своим историческим интересом, необычными свойствами или физиологической значимостью.
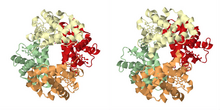
Как описано в историческом разделе, наиболее известным примером кооперативного связывания является гемоглобин . Его четвертичная структура, решенная Максом Перуцем с помощью рентгеновской дифракции, [21] демонстрирует псевдосимметричный тетраэдр, несущий четыре центра связывания (гема) для кислорода. Многие другие молекулярные ансамбли, демонстрирующие кооперативное связывание, были изучены очень подробно.
Активность многих ферментов регулируется аллостерическими эффекторами. Некоторые из этих ферментов являются мультимерными и несут несколько участков связывания для регуляторов.
Треониндезаминаза была одним из первых ферментов, предположительно ведущих себя подобно гемоглобину [22] и связывающих лиганды кооперативно. [23] Позднее было показано, что она является тетрамерным белком. [24]
Другим ферментом, который, как было ранее предложено, кооперативно связывает лиганды, является аспартат-транс-карбамилаза . [25] Хотя первоначальные модели соответствовали четырем сайтам связывания, [26] позднее Уильям Липскомб и его коллеги показали, что его структура является гексамерной . [27]
Большинство ионных каналов образованы несколькими идентичными или псевдоидентичными мономерами или доменами, расположенными симметрично в биологических мембранах. Несколько классов таких каналов, открытие которых регулируется лигандами, демонстрируют кооперативное связывание этих лигандов.
Еще в 1967 году [28] (когда точная природа этих каналов была еще неизвестна) было высказано предположение, что никотиновые ацетилхолиновые рецепторы связывают ацетилхолин кооперативным образом из-за существования нескольких участков связывания. Очистка рецептора [29] и его характеристика продемонстрировали пентамерную структуру с участками связывания, расположенными на интерфейсах между субъединицами, что подтверждается структурой домена связывания рецептора. [30]
Рецепторы инозитолтрифосфата (IP3) образуют другой класс лиганд-управляемых ионных каналов, демонстрирующих кооперативное связывание. [31] Структура этих рецепторов показывает четыре симметрично расположенных участка связывания IP3. [32]
Хотя большинство белков, демонстрирующих кооперативное связывание, представляют собой мультимерные комплексы гомологичных субъединиц, некоторые белки несут несколько участков связывания для одного и того же лиганда на одном и том же полипептиде. Одним из таких примеров является кальмодулин . Одна молекула кальмодулина кооперативно связывает четыре иона кальция. [33] Его структура представляет четыре домена EF-hand , [34] каждый из которых связывает один ион кальция. Молекула не демонстрирует квадратную или тетраэдрическую структуру, а образована двумя долями, каждая из которых несет два домена EF-hand.
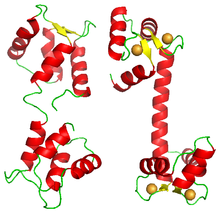
Также было показано кооперативное связывание белков с нуклеиновыми кислотами. Классическим примером является связывание репрессора фага лямбда с его операторами, которое происходит кооперативно. [35] [36] Другие примеры факторов транскрипции демонстрируют положительную кооперативность при связывании со своей целью, например, репрессор насосов TtgABC [37] (n=1,6), а также условную кооперативность, проявляемую факторами транскрипции HOXA11 и FOXO1 . [38]
Напротив, были также зарегистрированы примеры отрицательной кооперативности для связывания факторов транскрипции, как для гомодимерного репрессора оперона гидроксилазы цитохрома P450cam Pseudomonas putida [39] (n=0,56).
Ранее утверждалось, что некоторые белки, особенно те, которые состоят из многих субъединиц, могут регулироваться обобщенным механизмом MWC, в котором переход между состояниями R и T не обязательно синхронизирован по всему белку. [40] В 1969 году Уайман [41] предложил такую модель со «смешанными конформациями» (т. е. некоторые протомеры в состоянии R, некоторые в состоянии T) для дыхательных белков беспозвоночных.
Следуя схожей идее, модель конформационного распространения Дьюка и коллег [42] включает как модель KNF, так и модель MWC как особые случаи. В этой модели субъединица не меняет конформацию автоматически при связывании лиганда (как в модели KNF), и все субъединицы в комплексе не меняют конформации вместе (как в модели MWC). Конформационные изменения являются стохастическими с вероятностью переключения состояний субъединицы в зависимости от того, связана ли она с лигандом или нет, и от конформационного состояния соседних субъединиц. Таким образом, конформационные состояния могут «распространяться» по всему комплексу.
В живой клетке сверхчувствительные модули встроены в большую сеть с восходящими и нисходящими компонентами. Эти компоненты могут ограничивать диапазон входов, которые модуль будет получать, а также диапазон выходов модуля, которые сеть сможет обнаружить. [43] Чувствительность модульной системы зависит от этих ограничений. Ограничения динамического диапазона, накладываемые нисходящими компонентами, могут производить эффективную чувствительность, намного большую, чем у исходного модуля, если рассматривать его изолированно.
![]() Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 (2013) (отчеты рецензента): Melanie I Stefan; Nicolas Le Novère (2013). "Cooperative binding". PLOS Computational Biology . 9 (6): e1003106. doi : 10.1371/JOURNAL.PCBI.1003106 . ISSN 1553-734X. PMC 3699289. PMID 23843752. Wikidata Q21045427 .
Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 (2013) (отчеты рецензента): Melanie I Stefan; Nicolas Le Novère (2013). "Cooperative binding". PLOS Computational Biology . 9 (6): e1003106. doi : 10.1371/JOURNAL.PCBI.1003106 . ISSN 1553-734X. PMC 3699289. PMID 23843752. Wikidata Q21045427 .