Круговой дихроизм ( CD ) — это дихроизм , включающий циркулярно поляризованный свет, т. е. дифференциальное поглощение лево- и правополяризованного света . [1] [2] Левосторонний круговой (LHC) и правосторонний круговой (RHC) поляризованный свет представляют два возможных состояния спинового углового момента для фотона, и поэтому круговой дихроизм также называют дихроизмом спинового углового момента. [3] Это явление было открыто Жаном-Батистом Био , Огюстеном Френелем и Эме Коттоном в первой половине 19 века. [4] Круговой дихроизм и круговое двойное лучепреломление являются проявлениями оптической активности . Они проявляются в полосах поглощения оптически активных хиральных молекул. Спектроскопия CD имеет широкий спектр применения во многих различных областях. В частности, УФ -КД используется для исследования вторичной структуры белков. [5] УФ/видимый КД используется для исследования переходов с переносом заряда . [6] КД в ближнем инфракрасном диапазоне используется для исследования геометрической и электронной структуры путем зондирования переходов металлов d → d . [2] Вибрационный круговой дихроизм , который использует свет из инфракрасной энергетической области, используется для структурных исследований малых органических молекул, а в последнее время и белков и ДНК. [5]
Электромагнитное излучение состоит из электрического и магнитного поля, которые колеблются перпендикулярно друг другу и направлению распространения, [7] поперечная волна . В то время как линейно поляризованный свет возникает, когда вектор электрического поля колеблется только в одной плоскости, циркулярно поляризованный свет возникает, когда направление вектора электрического поля вращается вокруг направления его распространения, в то время как вектор сохраняет постоянную величину. В одной точке пространства циркулярно поляризованный вектор будет описывать окружность за один период частоты волны, отсюда и название. Две диаграммы ниже показывают векторы электрического поля линейно и циркулярно поляризованного света в один момент времени для диапазона положений; график циркулярно поляризованного электрического вектора образует спираль вдоль направления распространения . Для левополяризованного кругового света (LCP) с распространением к наблюдателю электрический вектор вращается против часовой стрелки . [2] Для правополяризованного кругового света (RCP) электрический вектор вращается по часовой стрелке.
Когда круговой поляризованный свет проходит через поглощающую оптически активную среду, скорости между правой и левой поляризациями различаются ( ), а также их длина волны ( ) и степень их поглощения ( ). Круговой дихроизм — это разница . [5] Электрическое поле светового луча вызывает линейное смещение заряда при взаимодействии с молекулой ( электрический диполь ), тогда как его магнитное поле вызывает циркуляцию заряда ( магнитный диполь ). Эти два движения в сочетании вызывают возбуждение электрона в винтовом движении, которое включает трансляцию и вращение и связанные с ними операторы . Экспериментально определенное соотношение между вращательной силой образца и задается выражением
Сила вращения также была определена теоретически,
Из этих двух уравнений видно, что для того, чтобы иметь ненулевое значение , операторы электрического и магнитного дипольного момента ( и ) должны преобразовываться как одно и то же неприводимое представление . и являются единственными точечными группами , где это может произойти, делая активными только хиральные молекулы CD.
Проще говоря, поскольку циркулярно поляризованный свет сам по себе является «хиральным», он взаимодействует с хиральными молекулами по-разному . То есть, два типа циркулярно поляризованного света поглощаются в разной степени. В эксперименте с КД равные количества левого и правого циркулярно поляризованного света выбранной длины волны попеременно излучаются в (хиральный) образец. Одна из двух поляризаций поглощается больше, чем другая, и эта зависящая от длины волны разница поглощения измеряется, давая спектр КД образца. Из-за взаимодействия с молекулой вектор электрического поля света вычерчивает эллиптическую траекторию после прохождения через образец.
Важно, что хиральность молекулы может быть конформационной, а не структурной. То есть, например, молекула белка со спиральной вторичной структурой может иметь КД, который изменяется при изменении конформации.
По определению,
где (дельта поглощения) — это разница между поглощением лево-циркулярно поляризованного (ЛЦП) и право-циркулярно поляризованного (ПЦП) света (именно это обычно измеряется). — это функция длины волны , поэтому для того, чтобы измерение имело смысл, необходимо знать длину волны, на которой оно проводилось.
Его также можно выразить, применяя закон Бера , как:
где
Затем
— молярный круговой дихроизм. Это внутреннее свойство — то, что обычно подразумевается под круговым дихроизмом вещества. Поскольку — функция длины волны, значение молярного кругового дихроизма ( ) должно указывать длину волны, при которой оно действительно.
Во многих практических применениях кругового дихроизма (КД), как обсуждается ниже, измеренный КД не является просто внутренним свойством молекулы, а скорее зависит от молекулярной конформации. В таком случае КД может также быть функцией температуры, концентрации и химической среды, включая растворители. В этом случае сообщаемое значение КД должно также указывать эти другие соответствующие факторы, чтобы быть значимым.
В упорядоченных структурах, не обладающих двойной вращательной симметрией, оптическая активность, [8] [9], включая дифференциальное пропускание [10] (и отражение [11] ) циркулярно поляризованных волн, также зависит от направления распространения через материал. В этом случае так называемая внешняя 3d-хиральность связана с взаимной ориентацией светового луча и структуры.
Хотя обычно измеряется, по историческим причинам большинство измерений сообщается в градусах эллиптичности. Молярная эллиптичность — это круговой дихроизм, скорректированный на концентрацию. Молярный круговой дихроизм и молярная эллиптичность, , легко преобразуются друг в друга с помощью уравнения:

Это соотношение выводится путем определения эллиптичности поляризации как:
где
Когда равно (когда нет разницы в поглощении право- и лево-кругово поляризованного света), составляет 0° и свет линейно поляризован . Когда либо или равно нулю (когда есть полное поглощение кругово поляризованного света в одном направлении), составляет 45° и свет кругово поляризован .
В общем случае эффект кругового дихроизма мал, поэтому мал и может быть аппроксимирован как в радианах . Поскольку интенсивность или облученность , , света пропорциональна квадрату вектора электрического поля, эллиптичность становится:
Затем, заменив I, используя закон Бера в форме натурального логарифма :
Эллиптичность теперь можно записать как:
Поскольку , это выражение можно аппроксимировать, разложив экспоненты в ряд Тейлора до первого порядка, а затем отбросив члены по сравнению с единицей и переведя из радиан в градусы:
Линейная зависимость концентрации растворенного вещества и длины пути устраняется путем определения молярной эллиптичности как,
Тогда, объединяя последние два выражения с законом Бера , молярная эллиптичность принимает вид:
Единицами молярной эллиптичности исторически являются (град·см2 / дмоль). Для расчета молярной эллиптичности необходимо знать концентрацию образца (г/л), длину пути ячейки (см) и молекулярную массу (г/моль).
Если образец представляет собой белок, вместо молекулярной массы часто используют среднюю массу остатка (среднюю молекулярную массу аминокислотных остатков, которые он содержит), по сути рассматривая белок как раствор аминокислот. Использование средней эллиптичности остатка облегчает сравнение CD белков с разной молекулярной массой; использование этого нормализованного CD важно при изучении структуры белка.
Методы оценки вторичной структуры полимеров, белков и полипептидов в частности часто требуют, чтобы измеренный спектр молярной эллиптичности был преобразован в нормализованное значение, в частности, в значение, не зависящее от длины полимера. Для этой цели используется средняя эллиптичность остатка; это просто измеренная молярная эллиптичность молекулы, деленная на число мономерных единиц (остатков) в молекуле.
В общем, это явление будет проявляться в полосах поглощения любой оптически активной молекулы. Как следствие, круговой дихроизм проявляется биологическими молекулами из-за их правовращающих и левовращающих компонентов. Еще более важно то, что вторичная структура также будет придавать отчетливый CD соответствующим молекулам. Поэтому альфа-спираль белков и двойная спираль нуклеиновых кислот имеют спектральные сигнатуры CD, репрезентативные для их структур. Способность CD давать репрезентативную структурную сигнатуру делает его мощным инструментом в современной биохимии с приложениями, которые можно найти практически в любой области изучения.
Метод CD тесно связан с методом оптической вращательной дисперсии (ORD) и обычно считается более продвинутым. CD измеряется в полосах поглощения интересующей молекулы или вблизи них, в то время как ORD может быть измерен вдали от этих полос. Преимущество CD очевидно при анализе данных. Структурные элементы более четко различаются, поскольку их зарегистрированные полосы не перекрываются в значительной степени на определенных длинах волн, как в ORD. В принципе, эти два спектральных измерения могут быть преобразованы друг в друга с помощью интегрального преобразования ( соотношение Крамерса–Кронига ), если все поглощения включены в измерения.
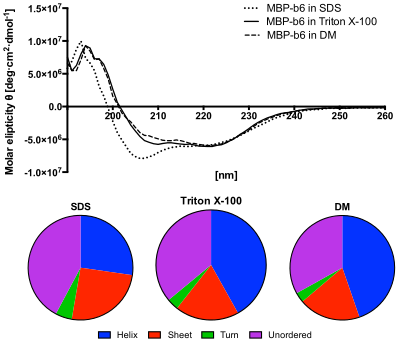
Спектр CD белков в дальнем УФ-диапазоне ( ультрафиолетовый ) может выявить важные характеристики их вторичной структуры . Спектры CD можно легко использовать для оценки доли молекулы, которая находится в конформации альфа-спирали , конформации бета-слоя , конформации бета-поворота или какой-либо другой (например, случайной спирали ) конформации. [13] [14] [15] [16] Эти дробные назначения накладывают важные ограничения на возможные вторичные конформации, в которых может находиться белок. CD, в общем, не может сказать, где обнаруженные альфа-спирали расположены внутри молекулы, или даже полностью предсказать, сколько их. Несмотря на это, CD является ценным инструментом, особенно для демонстрации изменений в конформации. Например, его можно использовать для изучения того, как вторичная структура молекулы изменяется в зависимости от температуры или концентрации денатурирующих агентов, например, хлорида гуанидиния или мочевины . Таким образом, он может раскрыть важную термодинамическую информацию о молекуле (такую как энтальпия и свободная энергия Гиббса денатурации), которую нельзя легко получить иным способом. Любой, кто попытается изучить белок, найдет CD ценным инструментом для проверки того, что белок находится в своей нативной конформации, прежде чем проводить с ним обширные и/или дорогостоящие эксперименты. Кроме того, существует ряд других применений спектроскопии CD в химии белков, не связанных с оценкой доли альфа-спирали. Более того, спектроскопия CD использовалась в исследованиях бионеорганического интерфейса. В частности, она использовалась для анализа различий во вторичной структуре сконструированного белка до и после титрования реагентом. [17]
Спектр CD в ближнем УФ-диапазоне (>250 нм) белков предоставляет информацию о третичной структуре . Сигналы, полученные в области 250–300 нм, обусловлены поглощением, дипольной ориентацией и природой окружающей среды аминокислот фенилаланина, тирозина, цистеина (или дисульфидных мостиков SS ) и триптофана . В отличие от CD в дальнем УФ-диапазоне, спектр CD в ближнем УФ-диапазоне не может быть отнесен к какой-либо конкретной трехмерной структуре. Вместо этого спектры CD в ближнем УФ-диапазоне предоставляют структурную информацию о природе простетических групп в белках, например, гемовых групп в гемоглобине и цитохроме c .
Видимая спектроскопия КД является очень мощным методом изучения взаимодействий металл-белок и может разрешать отдельные электронные переходы d–d как отдельные полосы. Спектры КД в видимой области света производятся только тогда, когда ион металла находится в хиральной среде, таким образом, свободные ионы металла в растворе не обнаруживаются. Это имеет преимущество наблюдения только за связанным с белком металлом, поэтому зависимость pH и стехиометрии легко получаются. Оптическая активность в комплексах ионов переходных металлов была отнесена к конфигурационным, конформационным и вицинальным эффектам. Klewpatinond и Viles (2007) разработали набор эмпирических правил для прогнозирования появления видимых спектров КД для квадратно-плоских комплексов Cu 2+ и Ni 2+, включающих координацию гистидина и основной цепи.
CD дает менее специфическую структурную информацию, чем рентгеновская кристаллография и белковая ЯМР- спектроскопия, например, которые оба дают данные с атомным разрешением. Однако CD-спектроскопия является быстрым методом, не требующим больших количеств белков или обширной обработки данных. Таким образом, CD можно использовать для исследования большого количества условий растворителя , изменяя температуру , pH , соленость и присутствие различных кофакторов.
Спектроскопия CD обычно используется для изучения белков в растворе, и таким образом она дополняет методы, которые изучают твердое состояние. Это также является ограничением, поскольку многие белки встроены в мембраны в своем нативном состоянии, а растворы, содержащие мембранные структуры, часто сильно рассеивают. CD иногда измеряют в тонких пленках.
Спектроскопия КД также проводилась с использованием полупроводниковых материалов, таких как TiO2 , для получения больших сигналов в УФ-диапазоне длин волн, где часто происходят электронные переходы для биомолекул. [18]
CD также изучался в углеводах , но с ограниченным успехом из-за экспериментальных трудностей, связанных с измерением спектров CD в области вакуумного ультрафиолета (ВУФ) спектра (100–200 нм), где лежат соответствующие полосы CD незамещенных углеводов. Замещенные углеводы с полосами выше области ВУФ были успешно измерены.
Измерение CD также осложняется тем фактом, что типичные водные буферные системы часто поглощают в диапазоне, где структурные особенности демонстрируют дифференциальное поглощение циркулярно поляризованного света. Фосфатные , сульфатные , карбонатные и ацетатные буферы, как правило, несовместимы с CD, если только они не сделаны чрезвычайно разбавленными, например, в диапазоне 10–50 мМ. Систему буфера TRIS следует полностью избегать при выполнении CD в дальнем УФ-диапазоне. Соединения бората и ония часто используются для установления подходящего диапазона pH для экспериментов с CD. Некоторые экспериментаторы заменили фторид на хлорид-ион, поскольку фторид поглощает меньше в дальнем УФ-диапазоне, а некоторые работали в чистой воде. Другой, почти универсальный, метод заключается в минимизации поглощения растворителя путем использования ячеек с более короткой длиной пути при работе в дальнем УФ-диапазоне, длины пути 0,1 мм не являются редкостью в этой работе.
Помимо измерения в водных системах, CD, особенно дальний УФ CD, можно измерять в органических растворителях, например, этаноле, метаноле, трифторэтаноле (ТФЭ). Последний имеет преимущество в том, что индуцирует структурообразование белков, индуцируя бета-слои в некоторых и альфа-спирали в других, которые они не показали бы в обычных водных условиях. Однако наиболее распространенные органические растворители, такие как ацетонитрил , ТГФ , хлороформ , дихлорметан , несовместимы с дальним УФ CD.
Интересно отметить, что спектры CD белков, используемые при оценке вторичной структуры, связаны с орбитальными поглощениями π-π* амидных связей, связывающих аминокислоты. Эти полосы поглощения частично лежат в так называемом вакуумном ультрафиолете (длины волн менее примерно 200 нм). Интересующая нас область длин волн фактически недоступна в воздухе из-за сильного поглощения света кислородом на этих длинах волн. На практике эти спектры измеряются не в вакууме, а в приборе, не содержащем кислорода (заполненном чистым азотом ).
После устранения кислорода, возможно, вторым по важности техническим фактором при работе ниже 200 нм является проектирование остальной части оптической системы с низкими потерями в этой области. В этом отношении критически важным является использование алюминированных зеркал , покрытия которых оптимизированы для низких потерь в этой области спектра.
Обычным источником света в этих приборах является ксеноновая лампа высокого давления с короткой дугой. Обычные ксеноновые дуговые лампы не подходят для использования в низком УФ-диапазоне. Вместо этого необходимо использовать специально сконструированные лампы с колбами из синтетического плавленого кварца высокой чистоты.
Свет от синхротронных источников имеет гораздо более высокий поток на коротких длинах волн и использовался для записи CD вплоть до 160 нм. В 2010 году спектрофотометр CD на электронном накопительном кольце ISA в Университете Орхуса в Дании использовался для записи твердотельных спектров CD вплоть до 120 нм. [19] На квантово-механическом уровне плотность признаков кругового дихроизма и оптического вращения идентична. Оптическая вращательная дисперсия и круговой дихроизм имеют одинаковое квантовое информационное содержание.