Фосфатаза легкой цепи миозина , также называемая миозинфосфатазой (EC 3.1.3.53; систематическое название [миозин-легкая-цепь]-фосфатфосфогидролаза ), представляет собой фермент (в частности, серин/треонин-специфическую протеинфосфатазу ), который дефосфорилирует регуляторную легкую цепь миозина II :
Эта реакция дефосфорилирования происходит в гладкой мышечной ткани и инициирует процесс расслабления мышечных клеток. Таким образом, миозинфосфатаза отменяет процесс сокращения мышц , инициированный киназой легкой цепи миозина . Фермент состоит из трех субъединиц: каталитической области ( протеинфосфатаза 1 или PP1), субъединицы связывания миозина (MYPT1) и третьей субъединицы (M20) неизвестной функции. Каталитическая область использует два иона марганца в качестве катализаторов для дефосфорилирования легких цепей на миозине, что вызывает конформационное изменение миозина и расслабляет мышцу. Фермент высококонсервативный [1] и обнаружен в гладкой мышечной ткани всех организмов. Хотя известно, что миозинфосфатаза регулируется rho-ассоциированными протеинкиназами , в настоящее время ведутся споры о том, регулируют ли фермент также другие молекулы, такие как арахидоновая кислота и цАМФ . [2]
Гладкая мышечная ткань в основном состоит из актина и миозина [3] , двух белков, которые взаимодействуют друг с другом, вызывая сокращение и расслабление мышц. Миозин II, также известный как обычный миозин, имеет две тяжелые цепи, которые состоят из доменов головы и хвоста, и четыре легкие цепи (по две на головку), которые связываются с тяжелыми цепями в области «шейки». Когда мышце необходимо сократиться, ионы кальция поступают в цитозоль из саркоплазматического ретикулума , где они активируют кальмодулин, который, в свою очередь, активирует киназу легкой цепи миозина (MLC-киназу). MLC-киназа фосфорилирует легкую цепь миозина (MLC 20 ) по остатку Ser-19. Это фосфорилирование вызывает конформационное изменение миозина, активируя цикл поперечных мостиков и заставляя мышцу сокращаться. Поскольку миозин претерпевает конформационное изменение, мышца будет оставаться сокращенной, даже если концентрации кальция и активированной MLC-киназы будут доведены до нормального уровня. Для расслабления мышцы необходимо отменить конформационное изменение. [4]
Когда миозиновая фосфатаза связывается с миозином, она удаляет фосфатную группу . Без группы миозин возвращается к своей исходной конформации, в которой он не может взаимодействовать с актином и удерживать мышцу в напряжении, поэтому мышца расслабляется. Мышца будет оставаться в этом расслабленном положении до тех пор, пока миозин не будет фосфорилирован MLC-киназой и не подвергнется конформационному изменению.

Миозинфосфатаза состоит из трех субъединиц. Каталитическая субъединица, PP1, является одной из наиболее важных Ser/Thr фосфатаз в эукариотических клетках , поскольку она играет роль в метаболизме гликогена , внутриклеточном транспорте, синтезе белка и делении клеток , а также в сокращении гладких мышц. [5] Поскольку она так важна для основных клеточных функций, и поскольку в клетках гораздо меньше протеинфосфатаз, чем киназ, [6] структура и функция PP1 высоко консервативны (хотя специфическая изоформа, используемая в миозинфосфатазе, — это δ-изоформа, PP1δ). [7] PP1 работает, используя два иона марганца в качестве катализаторов для дефосфорилирования (см. ниже).
Вокруг этих ионов находится Y-образная щель с тремя бороздками: гидрофобной, кислотной и С-концевой. Когда PP1 не связан ни с одной другой субъединицей, он не является особенно специфичным. Однако, когда он связывается со второй субъединицей миозиновой фосфатазы, MYPT1 (ММ ~130 кДа), эта каталитическая щель меняет конфигурацию. Это приводит к резкому увеличению специфичности миозина. [1] Таким образом, очевидно, что MYPT1 обладает большой регуляторной силой над PP1 и миозиновой фосфатазой, даже без присутствия других активаторов или ингибиторов.
Третья субъединица, M20 (не путать с MLC 20 , критической регуляторной субъединицей миозина), является самой маленькой и самой загадочной субъединицей. В настоящее время о M20 мало что известно, за исключением того, что она не нужна для катализа, поскольку удаление субъединицы не влияет на оборот или селективность. [1] Хотя некоторые полагают, что она может иметь регуляторную функцию, пока ничего не определено. [2]
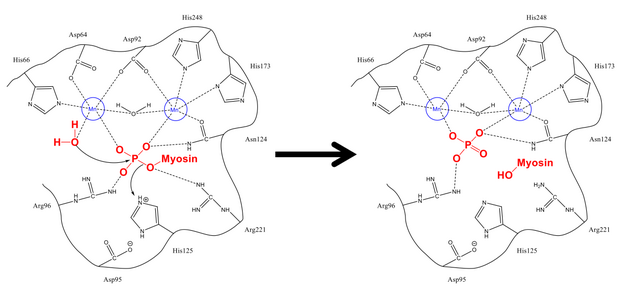
Механизм удаления фосфата из Ser-19 очень похож на другие реакции дефосфорилирования в клетке, такие как активация гликогенсинтазы . Регуляторная субъединица миозина MLC 20 связывается как с гидрофобными, так и с кислотными бороздками PP1 и MYPT1, регуляторного участка на миозинфосфатазе. [1] [8] После того, как они находятся в правильной конфигурации, как физофорилированный серин , так и свободная молекула воды стабилизируются остатками водородных связей в активном центре, а также положительно заряженными ионами (которые сильно взаимодействуют с отрицательной фосфатной группой). His-125 (на миозинфосфатазе) отдает протон Ser-19 MLC 20 ), и молекула воды атакует атом фосфора . После перетасовки протонов для стабилизации (что происходит быстро по сравнению с атакой на фосфор) образуются фосфат и спирт, и оба покидают активный центр.
Регуляторные пути MLC-киназы были хорошо изучены, но до конца 1980-х годов предполагалось, что миозиновая фосфатаза не регулируется, а сокращение/расслабление полностью зависят от активности MLC-киназы. [2] Однако с 1980-х годов был обнаружен и тщательно исследован ингибирующий эффект rho-ассоциированной протеинкиназы. [11] RhoA GTP активирует Rho-киназу , которая фосфорилирует MYPT1 в двух основных ингибирующих сайтах, Thr-696 и Thr-866. [12] [13] Это полностью демонстрирует ценность MYPT1 не только для увеличения скорости реакции и специфичности, но и для значительного замедления реакции. Однако при добавлении телокина он эффективно отменяет эффект Rho-киназы, хотя и не дефосфорилирует MYPT1. [12]
Еще одна предложенная стратегия регулирования включает арахидоновую кислоту. Когда арахидоновая кислота добавляется к напряженной мышечной ткани, кислота снижает скорость дефосфорилирования (и, таким образом, расслабления) миозина. Однако неясно, как арахидоновая кислота действует как ингибитор . [ 4] Две конкурирующие теории заключаются в том, что либо арахидоновая кислота действует как со-мессенджер в каскаде rho-киназы, упомянутом выше, либо она связывается с c-концом MYPT1. [4]
Когда регуляторные системы фосфатазы миозина начинают давать сбой, могут возникнуть серьезные последствия для здоровья. Поскольку гладкие мышцы находятся в дыхательной, кровеносной и репродуктивной системах человека (а также в других местах), если гладкие мышцы больше не могут расслабляться из-за неправильной регуляции, то может возникнуть широкий спектр проблем, начиная от астмы , гипертонии и эректильной дисфункции . [4] [14]