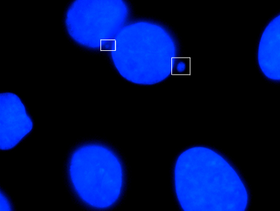
Микроядро — это небольшое ядро , которое образуется всякий раз, когда хромосома или фрагмент хромосомы не включается в одно из дочерних ядер во время деления клетки . Обычно это признак генотоксических событий и хромосомной нестабильности . Микроядра часто встречаются в раковых клетках и могут указывать на события геномного повреждения, которые могут увеличить риск развития дегенеративных заболеваний. [1]
Микроядра образуются во время анафазы из отстающих ацентрических хромосом или фрагментов хроматид, вызванных неправильно восстановленными или не восстановленными разрывами ДНК или нерасхождением хромосом. Эта неправильная сегрегация хромосом может быть результатом гипометилирования повторяющихся последовательностей, присутствующих в перицентромерной ДНК, нарушений в белках кинетохора или их сборке, дисфункционального веретенного аппарата или дефектных генов контрольных точек анафазы. [2] Микроядра могут способствовать нестабильности генома , способствуя катастрофическому мутационному событию, называемому хромотрипсисом . [3] Было разработано множество микроядерных анализов для проверки наличия этих структур и определения их частоты в клетках, подвергшихся воздействию определенных химических веществ или стрессовых условий.
Термин микронуклеус может также относиться к меньшему ядру у инфузорийных простейших , таких как Paramecium . В митозе он делится делением , а при конъюгации пара микронуклеусов гамет подвергается реципрокному слиянию, образуя ядро зиготы , которое дает начало макронуклеусам и микронуклеусам особей следующего цикла деления. [4]
Микроядра в новообразованных эритроцитах у людей известны как тельца Хауэлла-Джолли , поскольку эти структуры были впервые идентифицированы и описаны в эритроцитах гематологами Уильямом Хауэллом и Джастином Джолли. Позднее было обнаружено, что эти структуры связаны с дефицитом витаминов, таких как фолат и B12. Связь между образованием микроядер и воздействием факторов окружающей среды была впервые обнаружена в клетках кончика корня, подвергшихся воздействию ионизирующего излучения. Индукция микроядер химическим веществом была впервые обнаружена в клетках асцитной опухоли Эрлиха, обработанных колхицином. [2]
Микроядра в основном возникают из ацентрических фрагментов хромосом или отстающих целых хромосом, которые не включены в дочерние ядра, полученные в результате митоза, поскольку они не могут правильно прикрепиться к веретену во время сегрегации хромосом в анафазе. Эти полные хромосомы или фрагменты хроматид в конечном итоге заключены в ядерные мембраны и структурно похожи на обычные ядра, хотя и меньше по размеру. Это небольшое ядро называется микроядром. Образование микроядер можно наблюдать только в клетках, претерпевающих ядерное деление, и его можно четко увидеть, используя цитохалазина B для блокирования цитокинеза с целью получения двуядерных клеток . [2]
Ацентрические фрагменты хромосом могут возникать различными способами. Один из способов заключается в том, что неисправность двухцепочечных разрывов ДНК может привести к симметричным или асимметричным обменам хроматид и хромосом, а также к хроматидным и хромосомным фрагментам. Если повреждение ДНК превышает возможности клетки по восстановлению, неисправленные двухцепочечные разрывы ДНК также могут привести к ацентрическим фрагментам хромосом. Другой способ возникновения эксцентрических фрагментов хромосом заключается в том, что дефекты в генах, связанных с гомологичной рекомбинационной репарацией (например, ATM, BRCA1, BRCA2 и RAD51), приводят к дисфункциональному безошибочному пути гомологичной рекомбинационной репарации ДНК и заставляют клетку прибегать к подверженному ошибкам пути репарации негомологичного соединения концов (NHEJ), что увеличивает вероятность неправильного восстановления разрывов ДНК, образования дицентрических хромосом и ацентрических фрагментов хромосом. Если ферменты в пути репарации NHEJ также дефектны, разрывы ДНК могут вообще не быть восстановлены. Кроме того, одновременная эксцизионная репарация поврежденных или неподходящих оснований, включенных в ДНК, которые находятся поблизости и на противоположных комплементарных цепях ДНК, может привести к двухцепочечным разрывам ДНК и образованию микроядер, особенно если этап заполнения пробелов пути репарации не завершен. [2]
Микроядра также могут образовываться из фрагментированных хромосом, когда нуклеоплазматические мостики (NPB) формируются, растягиваются и разрываются во время телофазы. [2]
Образование микроядер может также быть результатом неправильной сегрегации хромосом во время анафазы. Гипометилирование цитозина в центромерных и перицентромерных областях и повторы более высокого порядка сателлитной ДНК в центромерной ДНК могут приводить к таким событиям потери хромосом. Классическая сателлитная ДНК обычно сильно метилирована по остаткам цитозина, но может стать почти полностью неметилированной из-за синдрома ICF (синдром иммунодефицита, нестабильности центромеры и лицевых аномалий) или после лечения ингибиторами ДНК-метилтрансферазы. Поскольку сборка кинетохорных белков в центромерах зависит от метилирования цитозина и гистоновых белков, снижение целостности гетерохроматина в результате гипометилирования может мешать прикреплению микротрубочек к хромосомам и восприятию натяжения от правильных соединений микротрубочек и кинетохор. Другие возможные причины потери хромосом, которые могут привести к образованию микроядер, — это дефекты во взаимодействии кинетохор и микротрубочек, дефекты сборки митотического веретена, дефекты контрольных точек митоза, аномальная амплификация центросомы и слияния теломерных концов, которые приводят к дицентрическим хромосомам, которые отрываются от веретена во время анафазы. Микроядра, возникающие в результате событий потери хромосом, и ацентрические фрагменты хромосом можно различить с помощью панцентромерных ДНК-зондов. [2]
Число микроядер на клетку можно предсказать, используя следующую формулу:
AF — число ацентрических фрагментов, а F = 0,5 - 0,5P, где P — вероятность того, что фрагменты войдут в традиционное ядро и не сформируют микроядро. [5]
В одном исследовании, в котором для окрашивания ядерного материала использовался краситель Гимза, были установлены следующие критерии идентификации микроядер:
1) диаметр менее 1/3 первичного ядра,
2) неретракционность (исключает мелкие частицы красителя),
3) цвет такой же или светлее основного ядра (исключает крупные частицы красителя),
4) расположение в пределах 3 или 4 ядерных диаметров основного ядра, не касаясь его, и
5) не более двух, связанных с одним первичным ядром (3 или более микроядер, вероятно, являются полиморфами или прорубицитами с ядерными фрагментами). [6]
Микроядерные тесты предоставляют важную информацию о способности химикатов влиять на структуру и функцию хромосом. Например, многие известные человеческие канцерогены дают положительный результат в микроядерных тестах млекопитающих. В этих тестах организмы обрабатываются химикатом и измеряется полученная частота микроядерных клеток. Если наблюдается заметное увеличение числа клеток с микроядрами, можно сделать вывод, что химикат вызывает структурные и/или числовые хромосомные повреждения. Поскольку микроядерные тесты должны проводиться на активно делящихся клетках, стволовые клетки костного мозга и эритроциты, которые они производят посредством деления клеток, являются идеальными кандидатами. Эти клетки испытывают постоянный, быстрый оборот, а отсутствие настоящего ядра в эритроцитах делает микроядра легко видимыми под микроскопом. [1]
Системы микроядерного анализа очень экономичны, требуют гораздо меньше навыков в оценке, чем обычные метафазные тесты, и намного быстрее, чем эти обычные тесты. Поскольку микроядерные анализы надежно и быстро отражают хромосомные аберрации, они чрезвычайно полезны для быстрой оценки хромосомных повреждений. В частности, анализ CBMNcyt (микроядерный цитом с блокировкой цитокинеза) чрезвычайно универсален и является одним из предпочтительных методов измерения уровня хромосомных повреждений и хромосомной нестабильности в клетках. Микроядерный анализ с блокировкой цитокинеза (CBMN) был впервые разработан для оценки микроядер в клетках, которые завершили ядерное деление, путем их блокирования на стадии двуядерных клеток перед цитокинезом. Позднее он превратился в анализ CBMN «цитом» для дальнейшего изучения гибели клеток, цитостаза и биомаркеров повреждения ДНК. Основным недостатком использования микроядерных тестов является то, что они не позволяют определить различные типы хромосомных аберраций и могут зависеть от скорости митоза и доли гибели клеток, что искажает результаты. [2]

Многочисленные исследования показали, что частота микроядер у женщин выше, чем у мужчин, и что количество микроядер увеличивается примерно до 70 лет. Уровни микроядер варьировались от 0,5 до 1,4% у мужчин и от 0,9 до 1,8% у женщин. Гендерные различия в основном наблюдались в более молодых возрастных группах (<= 50 лет) с почти двукратной разницей между мужчинами и женщинами. Закономерности в количестве микроядер после 70 лет являются спорными. Некоторые исследования показали, что у лиц старше 70 лет частота микроядер увеличивается у обоих полов. С другой стороны, другие исследования показали, что в самых старших возрастных группах частоты микроядер выравниваются. Дефицит микроядер в некоторых из самых старших возрастных групп может быть объяснен тем фактом, что микроядерные клетки преимущественно устраняются апоптозом. Однако более высокая частота микроядер соответствует сниженной эффективности восстановления ДНК и повышенной геномной нестабильности, которые типичны для пожилых людей. Возрастное увеличение частоты микроядер также хорошо коррелирует с возрастным увеличением гипоплоидии и возрастным увеличением потери половых хромосом. С другой стороны, выравнивание частоты микроядер у пожилых людей может указывать на порог геномной нестабильности, который нельзя преодолеть, если человек хочет выжить. Если бы это было так, женщины, по-видимому, достигают этого порога быстрее, чем мужчины. [7]
Половые хромосомы вносят вклад в большинство случаев потери хромосом с возрастом. У женщин Х-хромосома может составлять до 72% наблюдаемых микроядер, из которых 37%, по-видимому, не имеют функциональной сборки кинетохора, возможно, из-за инактивации Х-хромосомы. Многочисленные исследования показали, что частоты аутосомно-положительных микроядер у обоих полов и половых хромосомно-положительных МН у мужчин были схожи и оставались неизменными в группах старшего возраста, в то время как частота Х-положительных МН у женщин была выше, чем средняя частота аутосомно-положительных МН и продолжала увеличиваться до самого старшего возраста. [2]
Частота хромосомных аберраций, поврежденных клеток и микроядер значительно выше у курильщиков, чем у некурящих. [8]
У нормальных людей и многих других млекопитающих, у которых нет ядер в эритроцитах, микроядра быстро удаляются селезенкой . Поэтому высокая частота микроядер в периферической крови человека указывает на разрыв или отсутствие селезенки. У мышей они не удаляются, что является основой для микроядерного теста in vivo .