В термодинамике энтальпия / ˈ ɛ n θ əl p i / _ ⓘ представляет собой суммувнутренней энергиитермодинамической системыипроизведения еедавлениянаобъем. [1]Этофункция состояния, используемая во многих измерениях в химических, биологических и физических системах при постоянном внешнем давлении, которое удобно обеспечивается большой окружающей атмосферой. Термин давление-объем выражает работу,которая была совершена против постоянного внешнего давления,чтобы установить физические размеры системы отдо некоторого конечного объема(как), то есть освободить для нее место путем смещения ее окружения. [2][3]Соотношение давление-объем очень мало для твердых тел и жидкостей в обычных условиях и довольно мало для газов. Следовательно, энтальпия является заменой энергии в химических системах; связь,решетка,сольватацияи другие химические «энергии» на самом деле представляют собой разницу энтальпий. Как функция состояния энтальпия зависит только от окончательной конфигурации внутренней энергии, давления и объема, а не от пути, пройденного для ее достижения.
В Международной системе единиц (СИ) единицей измерения энтальпии является джоуль . Другие исторические условные единицы, которые до сих пор используются, включают калорию и британскую тепловую единицу (БТЕ).
Полную энтальпию системы невозможно измерить напрямую, поскольку внутренняя энергия содержит компоненты, которые неизвестны, труднодоступны или не представляют интереса для рассматриваемой термодинамической задачи. На практике изменение энтальпии является предпочтительным выражением для измерений при постоянном давлении, поскольку оно упрощает описание переноса энергии . Когда перенос вещества в систему или из нее также предотвращается и не совершается никакая электрическая или механическая работа (перемешивающий вал или подъемная перекачка), при постоянном давлении изменение энтальпии равняется энергии, которой обмениваются с окружающей средой теплом .
В химии стандартная энтальпия реакции — это изменение энтальпии, когда реагенты в их стандартных состояниях ( р = 1 бар ; обычно Т = 298 К ) превращаются в продукты в их стандартных состояниях. [4] Эта величина представляет собой стандартную теплоту реакции при постоянных давлении и температуре, но ее можно измерить калориметрическими методами, даже если температура в ходе измерения меняется, при условии, что начальное и конечное давление и температура соответствуют стандартному состоянию. Величина не зависит от пути от начального до конечного состояния, поскольку энтальпия является функцией состояния .
Энтальпии химических веществ обычно указываются для давления 1 бар (100 кПа) в качестве стандартного состояния. Энтальпии и изменения энтальпии реакций изменяются в зависимости от температуры, [5] , но в таблицах обычно указаны стандартные теплоты образования веществ при 25 ° C (298 К). Для эндотермических (теплопоглощающих) процессов изменение ΔH имеет положительную величину ; для экзотермических (тепловыделительных) процессов он отрицателен.
Энтальпия идеального газа не зависит от его давления или объема и зависит только от его температуры, которая коррелирует с его тепловой энергией. Реальные газы при обычных температурах и давлениях часто очень близки к такому поведению, что упрощает практическое термодинамическое проектирование и анализ.
Энтальпия H термодинамической системы определяется как сумма ее внутренней энергии и произведения ее давления на объем: [1]
где U — внутренняя энергия , p — давление , V — объём системы; p V иногда называют энергией давления Ɛ p . [6]
Энтальпия — обширное свойство ; он пропорционален размеру системы (для однородных систем). В качестве интенсивных свойств удельная энтальпия h = ЧАС /м , относится к единице массы m системы, а молярная энтальпия , H m = ЧАС /н, где n — количество молей . Для неоднородных систем энтальпия представляет собой сумму энтальпий составляющих подсистем:
Закрытая система может находиться в термодинамическом равновесии в статическом гравитационном поле , так что ее давление p непрерывно меняется с высотой , в то время как из-за требования равновесия ее температура T инвариантна с высотой. (Соответственно, плотность потенциальной гравитационной энергии системы также меняется с высотой.) Тогда сумма энтальпий становится интегралом :
Таким образом, интеграл представляет собой сумму энтальпий всех элементов объема.
Энтальпия замкнутой однородной системы - это ее энергетическая функция H ( S , p ) , с ее энтропией S [ p ] и давлением p как естественными переменными состояния , которые обеспечивают дифференциальное соотношение для d H простейшей формы, полученное следующим образом. Начнем с первого закона термодинамики для закрытых систем для бесконечно малого процесса:
где
В однородной системе, в которой рассматриваются только обратимые процессы или чистая теплопередача, второй закон термодинамики дает δ Q = T d S , где T - абсолютная температура , а d S - бесконечно малое изменение энтропии S системы. Более того, если совершается только p V работы, δ W = p d V . Как результат,
Добавление d( p V ) к обеим частям этого выражения дает
или
Так
а коэффициенты дифференциалов натуральных переменных d S и d p представляют собой всего лишь отдельные переменные T и V .
Вышеприведенное выражение d H через энтропию и давление может быть незнакомо некоторым читателям. Существуют также выражения в терминах более непосредственно измеримых переменных, таких как температура и давление: [7] (стр. 88) [8]
Здесь C p — теплоемкость при постоянном давлении , а α — коэффициент (кубического) теплового расширения :
С помощью этого выражения в принципе можно определить энтальпию, если C p и V известны как функции p и T . Однако выражение более сложное, чем потому , что T не является естественной переменной для энтальпии H.
При постоянном давлении, так что Для идеального газа , приводит к этой форме, даже если процесс включает изменение давления, поскольку α T = 1 . [примечание 1]
В более общей форме первый закон описывает внутреннюю энергию с дополнительными членами, включающими химический потенциал и количество частиц различных типов. Дифференциальное утверждение для d H тогда становится
где μ i — химический потенциал на одну частицу для частицы типа i , а N i — количество таких частиц. Последний член также можно записать как μ i d n i (где d n i 0 — количество молей компонента i, добавленного в систему, и, в данном случае, μ i — молярный химический потенциал) или как μ i d m i (где d m i — масса компонента i, добавленного в систему, и, в данном случае, μ i — удельный химический потенциал).
Энтальпия H ( S [ p ], p , { N i }) выражает термодинамику системы в энергетическом представлении . Как функция состояния , его аргументы включают как одну интенсивную, так и несколько экстенсивных переменных состояния . Переменные состояния S [ p ] , p и { N i } называются естественными переменными состояния в этом представлении. Они подходят для описания процессов, в которых они определяются факторами окружающей среды. Например, когда виртуальный пакет атмосферного воздуха перемещается на другую высоту, давление вокруг него меняется, и процесс часто настолько быстрый, что времени для передачи тепла остается слишком мало. На этом основано так называемое адиабатическое приближение , которое используется в метеорологии . [9]
Сопряженная с энтальпией, с этими аргументами, другая характеристическая функция состояния термодинамической системы - это ее энтропия как функция S [ p ]( H , p , {N i } ) того же списка переменных состояния , за исключением того, что энтропия S [ p ] заменяется в списке энтальпией H . Оно выражает представление энтропии . Переменные состояния H , p и { N i } называются естественными переменными состояния в этом представлении. Они подходят для описания процессов, в которых контролируются экспериментально. Например, H и p можно контролировать, допуская передачу тепла и изменяя только внешнее давление на поршень, который устанавливает объем системы. [10] [11] [12]
Член U представляет собой энергию системы, а член p V можно интерпретировать как работу , которая потребовалась бы, чтобы «освободить место» для системы, если бы давление окружающей среды оставалось постоянным. Когда система, например, n молей газа объемом V при давлении p и температуре T , создается или приводится в текущее состояние от абсолютного нуля , необходимо подвести энергию, равную ее внутренней энергии U плюс pV , где p V — работа , совершаемая при толкании против окружающего (атмосферного) давления.
В физике и статистической механике может быть более интересно изучать внутренние свойства системы постоянного объема, поэтому используется внутренняя энергия. [13] [14] В химии эксперименты часто проводятся при постоянном атмосферном давлении , а работа давление-объем представляет собой небольшой, четко определенный обмен энергией с атмосферой, так что Δ H является подходящим выражением для теплоты реакции. . Для теплового двигателя изменение его энтальпии после полного цикла равно нулю, поскольку конечное и начальное состояние равны.
Чтобы обсудить связь между увеличением энтальпии и подводом тепла, мы вернемся к первому закону для закрытых систем с физическим соглашением о знаках: d U = δ Q − δ W , где тепло δ Q передается за счет проводимости, излучения , Джоулево нагрев . Применим его к частному случаю с постоянным давлением на поверхности. В этом случае работа определяется как p d V (где p — давление на поверхности, d V — увеличение объема системы). Случаи дальнодействующего электромагнитного взаимодействия требуют дополнительных переменных состояния в их формулировке и здесь не рассматриваются. В этом случае первый закон гласит:
Сейчас,
Так
Если система находится под постоянным давлением , d p = 0 и, следовательно, прирост энтальпии системы равен подведенному теплу :
Вот почему в XIX веке использовался устаревший термин « теплосодержание» .
В термодинамике можно вычислить энтальпию, определив требования для создания системы из «ничто»; требуемая механическая работа p V различается в зависимости от условий, возникающих при создании термодинамической системы .
Энергия должна быть подана для удаления частиц из окружающей среды, чтобы освободить место для создания системы, при условии, что давление p остается постоянным; это термин p V. Подаваемая энергия должна также обеспечивать изменение внутренней энергии U , которая включает в себя энергии активации , энергии ионизации, энергии смешивания, энергии испарения, энергии химической связи и т. д. Вместе они составляют изменение энтальпии U + p V . Для систем с постоянным давлением, в которых не совершается никакая внешняя работа, кроме работы p V , изменение энтальпии представляет собой тепло, полученное системой.
Для простой системы с постоянным числом частиц при постоянном давлении разница в энтальпии представляет собой максимальное количество тепловой энергии, получаемой в результате изобарного термодинамического процесса. [15]
Полную энтальпию системы невозможно измерить напрямую; Вместо этого измеряется изменение энтальпии системы . Изменение энтальпии определяется следующим уравнением:
Для экзотермической реакции при постоянном давлении изменение энтальпии системы Δ H отрицательно, поскольку продукты реакции имеют меньшую энтальпию, чем реагенты, и равняется теплу, выделяемому в реакции, если не совершается электрическая работа или работа вала. . Другими словами, общее снижение энтальпии достигается за счет выделения тепла. [16] И наоборот, для эндотермической реакции при постоянном давлении Δ H положительна и равна теплу, поглощенному в реакции.
Из определения энтальпии как H = U + p V , изменение энтальпии при постоянном давлении равно Δ H = Δ U + p Δ V . Однако для большинства химических реакций рабочий член p Δ V намного меньше изменения внутренней энергии Δ U , которое примерно равно Δ H . Например, для сгорания угарного газа 2 CO(г) + O 2 (г) → 2 CO 2 (г) Δ H = -566,0 кДж и Δ U = -563,5 кДж. [17] Поскольку различия настолько малы, энтальпии реакции часто описываются как энергии реакции и анализируются с точки зрения энергий связи .
Удельная энтальпия однородной системы определяется как h = ЧАС/ м где m — масса системы. Единицей удельной энтальпии в системе СИ является джоуль на килограмм. В других конкретных величинах ее можно выразить как h = u + pv , где u — удельная внутренняя энергия , p — давление, а v — удельный объем , равный 1 /ρ, где ρ — плотность .
Изменение энтальпии описывает изменение энтальпии, наблюдаемое в компонентах термодинамической системы при превращении или химической реакции. Это разница между энтальпией после завершения процесса, т. е. энтальпией продуктов при условии, что реакция дошла до завершения, и начальной энтальпией системы, а именно реагентов. Эти процессы определяются исключительно их начальным и конечным состояниями, так что изменение энтальпии для обратного процесса является отрицательным, чем для прямого процесса.
Обычным стандартным изменением энтальпии является энтальпия образования , которая определена для большого числа веществ. Изменения энтальпии регулярно измеряются и обобщаются в химических и физических справочных изданиях, таких как Справочник CRC по химии и физике . Ниже приводится подборка изменений энтальпии, обычно признаваемых в термодинамике.
При использовании этих общепризнанных терминов изменение квалификатора обычно опускается и свойство называется просто энтальпией «процесса» . Поскольку эти свойства часто используются в качестве эталонных значений, их очень часто называют для стандартизированного набора параметров окружающей среды или стандартных условий , в том числе:
Для таких стандартизированных значений к названию энтальпии обычно добавляется термин « стандарт» , например, стандартная энтальпия образования .
Энтальпия реакции – определяется как изменение энтальпии, наблюдаемое в компоненте термодинамической системы, когда один моль вещества вступает в реакцию полностью.
Энтальпия образования - определяется как изменение энтальпии, наблюдаемое в компоненте термодинамической системы, когда один моль соединения образуется из его элементарных предшественников.
Энтальпия сгорания – определяется как изменение энтальпии, наблюдаемое в компоненте термодинамической системы, когда один моль вещества полностью сгорает с кислородом.
Энтальпия гидрирования — определяется как изменение энтальпии, наблюдаемое в компоненте термодинамической системы, когда один моль ненасыщенного соединения полностью реагирует с избытком водорода с образованием насыщенного соединения .
Энтальпия распыления – определяется как изменение энтальпии, необходимое для полного разделения одного моля вещества на составляющие его атомы .
Энтальпия нейтрализации – определяется как изменение энтальпии, наблюдаемое в компоненте термодинамической системы, когда при реакции кислоты и основания образуется один моль воды.
Стандартная энтальпия раствора – определяется как изменение энтальпии, наблюдаемое в компоненте термодинамической системы, когда один моль растворенного вещества полностью растворяется в избытке растворителя, так что раствор находится в бесконечном разбавлении.
Стандартная энтальпия денатурации (биохимия) – определяется как изменение энтальпии, необходимое для денатурации одного моля соединения.
Энтальпия гидратации – определяется как изменение энтальпии, наблюдаемое при полном растворении одного моля газообразных ионов в воде с образованием одного моля водных ионов.
Энтальпия плавления – определяется как изменение энтальпии, необходимое для полного изменения состояния одного моля вещества из твердого в жидкое.
Энтальпия парообразования - определяется как изменение энтальпии, необходимое для полного перехода одного моля вещества из жидкого в газообразное.
Энтальпия сублимации – определяется как изменение энтальпии, необходимое для полного перехода одного моля вещества из твердого состояния в газообразное.
Энтальпия решетки - определяется как энергия, необходимая для разделения одного моля ионного соединения на отдельные газообразные ионы на бесконечное расстояние друг от друга (что означает отсутствие силы притяжения).
Энтальпия смешения – определяется как изменение энтальпии при смешивании двух (нереагирующих) химических веществ.
В термодинамических открытых системах масса (веществ) может втекать и выходить из границ системы. Первый закон термодинамики для открытых систем гласит: увеличение внутренней энергии системы равно количеству энергии, добавленной к системе за счет притока массы и нагревания, за вычетом количества, потерянного за счет вытекания массы и в виде работы, выполненной системой:
где U in — средняя внутренняя энергия, поступающая в систему, а U out — средняя внутренняя энергия, покидающая систему.

Область пространства, ограниченная границами открытой системы, обычно называется контрольным объемом и может соответствовать, а может и не соответствовать физическим стенам. Если мы выберем форму управляющего объема так, чтобы весь приток и выход происходил перпендикулярно его поверхности, то приток массы в систему совершает работу так, как если бы это был поршень с жидкостью, толкающий массу в систему, и система выполняет работу работайте над вытеканием массы так, как если бы она приводила в движение поршень с жидкостью. Тогда выполняются два типа работы: работа потока, описанная выше, которая выполняется над жидкостью (ее также часто называют p V работой ), и механическая работа ( работа вала ), которая может быть выполнена каким-либо механическим устройством, например турбина или насос.
Эти два вида работы выражаются уравнением
Подстановка контрольного объема (cv) в приведенное выше уравнение дает:
Определение энтальпии H позволяет нам использовать этот термодинамический потенциал для учета как внутренней энергии, так и работы p V в жидкостях для открытых систем:
Если мы допустим также перемещение границы системы (например, за счет перемещения поршней), мы получим довольно общую форму первого закона для открытых систем. [18] Что касается производных по времени, используя точечную запись Ньютона для производных по времени, это звучит так:
с суммами по различным местам k , куда подводится тепло, поступает масса в систему и границы перемещаются. k члены представляют собой потоки энтальпии, которые можно записать как
с k массовый расход и k молярный поток в положении k соответственно. Термин д В к / д т представляет собой скорость изменения объема системы в позиции k , что приводит к мощности p V , вырабатываемой системой. Параметр P представляет все другие формы мощности, вырабатываемые системой, такие как мощность на валу, но это также может быть, скажем, электроэнергия, производимая электростанцией.
Обратите внимание, что предыдущее выражение справедливо только в том случае, если скорость потока кинетической энергии сохраняется между входом и выходом системы. [ необходимы разъяснения ] В противном случае его необходимо включить в баланс энтальпии. При установившейся работе устройства ( см. турбина , насос , двигатель ) среднее значение д У /д тможет быть установлен равным нулю. Это дает полезное выражение для средней выработки мощности этими устройствами в отсутствие химических реакций:
где угловые скобки обозначают средние значения по времени. Техническое значение энтальпии напрямую связано с ее наличием в первом законе открытых систем, сформулированном выше.

Значения энтальпии важных веществ можно получить с помощью коммерческого программного обеспечения. Практически все соответствующие свойства материалов можно получить либо в табличной, либо в графической форме. Существует много типов диаграмм, таких как диаграммы h – T , которые показывают удельную энтальпию как функцию температуры для различных давлений, и диаграммы h – p , которые показывают h как функцию p для различных T . Одной из наиболее распространенных диаграмм является диаграмма энтропии, зависящая от температуры ( диаграмма T – s ). Он дает кривую плавления и значения насыщенной жидкости и пара вместе с изобарами и изентальпами. Эти диаграммы являются мощным инструментом в руках инженера-теплотехника.
Точки от a до h на рисунке играют роль в обсуждении в этом разделе.
Точки е и g — насыщенные жидкости, а точка h — насыщенный газ.
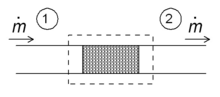
Одним из простых применений понятия энтальпии является так называемый процесс дросселирования, также известный как расширение Джоуля-Томсона . Речь идет об устойчивом адиабатическом течении жидкости через гидравлическое сопротивление (клапан, пористую пробку или любой другой тип гидравлического сопротивления), как показано на рисунке. Этот процесс очень важен, поскольку он лежит в основе бытовых холодильников и отвечает за перепад температур между температурой окружающей среды и внутренней частью холодильника. Это также последняя стадия во многих типах ожижителей .
Для установившегося режима течения энтальпия системы (пунктирный прямоугольник) должна быть постоянной. Следовательно
Поскольку массовый расход постоянен, удельные энтальпии по обе стороны сопротивления потоку одинаковы:
то есть энтальпия на единицу массы при дросселировании не меняется. Последствия этого соотношения можно продемонстрировать с помощью диаграммы T - s, приведенной выше.
Точка c соответствует давлению 200 бар и комнатной температуре (300 К). Расширение Джоуля-Томсона от 200 бар до 1 бар следует кривой постоянной энтальпии примерно 425. кДж /кг(на схеме не показан) лежит между 400 и 450 кДж /кгизэнтальп и заканчивается в точке d , которая находится при температуре около 270 К. Следовательно, расширение с 200 бар до 1 бар охлаждает азот с 300 К до 270 К. В клапане возникает большое трение и выделяется много энтропии, но конечная температура все равно ниже стартового значения.
Точка е выбрана так, чтобы она находилась на линии насыщенной жидкости с h = 100. кДж /кг. Это примерно соответствует p = 13 бар и T = 108 К. Дросселирование от этой точки до давления 1 бар заканчивается в двухфазной области (точка f ). Это означает, что смесь газа и жидкости выходит из дроссельного клапана. Поскольку энтальпия является расширенным параметром, энтальпия в f ( h f ) равна энтальпии в g ( h g ) , умноженной на долю жидкости в f ( x f ), плюс энтальпия в h ( h h ), умноженная на доля газа в ж (1 - Икс ж ) . Так
С цифрами:
Это означает, что массовая доля жидкости в газожидкостной смеси, выходящей из дросселирующего клапана, составляет 64%.

Мощность P применяется, например, как электрическая мощность. Если сжатие адиабатическое , температура газа повышается. В обратимом случае это будет постоянная энтропия, что соответствует вертикальной линии на диаграмме T – s . Например, сжатие азота с 1 бар (точка а ) до 2 бар (точка б ) приведет к повышению температуры с 300 К до 380 К. Чтобы позволить сжатому газу выйти при температуре окружающей среды Т а , необходимо осуществить теплообмен, например необходимо охлаждающей водой. В идеальном случае сжатие изотермическое. Средний тепловой поток в окружающую среду равен Q̇ . Поскольку система находится в установившемся состоянии, первый закон дает
Минимальная мощность, необходимая для сжатия, достигается, если сжатие обратимо. В этом случае второй закон термодинамики для открытых систем дает
Устранение Q̇ дает минимальную мощность
Например, сжатие 1 кг азота с давления 1 бар до 200 бар стоит как минимум: ( час c - час a ) - T a ( s c - s a ) . По данным, полученным с помощью диаграммы T – s , находим значение (430 – 461) – 300 × (5,16 – 6,85) = 476. кДж /кг.
Отношение для мощности можно еще упростить, записав его в виде
С
это приводит к окончательному соотношению
Термин энтальпия появился относительно поздно в истории термодинамики, в начале 20 века. Энергия в современном смысле была введена Томасом Янгом в 1802 году, а энтропия была придумана Рудольфом Клаузиусом в 1865 году . Энергия использует корень греческого слова ἔργον ( эргон ), означающего «работа», для выражения идеи способности выполнять работу. . Энтропия использует греческое слово τροπή ( тропе ), означающее трансформацию или поворот . Энтальпия использует корень греческого слова θάλπος ( thalpos ) «тепло, тепло». [20]
Этот термин выражает устаревшую концепцию теплосодержания [ примечание 2] , поскольку d H относится к количеству тепла, полученному в процессе только при постоянном давлении [21] , но не в общем случае, когда давление является переменным. [16] Дж. Гиббс для ясности использовал термин «тепловая функция для постоянного давления». [заметка 3]
Введение понятия «теплосодержание» H связано с Бенуа-Полем Эмилем Клапейроном и Рудольфом Клаузиусом ( соотношение Клаузиуса-Клапейрона , 1850).
Термин «энтальпия» впервые появился в печати в 1909 году. [24] Его приписывают Хайке Камерлинг-Оннесу , который, скорее всего, представил его устно годом ранее, на первом заседании Института холода в Париже. [25] Он получил распространение только в 1920-х годах, особенно с « Таблицами и диаграммами Молье Стима» , опубликованными в 1927 году.
До 1920-х годов символ H использовался несколько непоследовательно для обозначения «тепла» в целом. Определение H как строго ограниченного энтальпией или «теплосодержанием при постоянном давлении» было официально предложено А.В. Портером в 1922 году. [26] [27]