Нуклеозидтрифосфат — это нуклеозид , содержащий азотистое основание , связанное с 5-углеродным сахаром ( рибозой или дезоксирибозой ), с тремя фосфатными группами, связанными с сахаром. [1] Они являются молекулярными предшественниками как ДНК, так и РНК , которые представляют собой цепи нуклеотидов, созданные в процессе репликации и транскрипции ДНК . [2] Нуклеозидтрифосфаты также служат источником энергии для клеточных реакций [3] и участвуют в сигнальных путях. [4]
Нуклеозидтрифосфаты не могут легко пересекать клеточную мембрану, поэтому они обычно синтезируются внутри клетки. [5] Пути синтеза различаются в зависимости от конкретного производимого нуклеозидтрифосфата, но, учитывая множество важных ролей нуклеозидтрифосфатов, синтез строго регулируется во всех случаях. [6] Аналоги нуклеозидов также могут использоваться для лечения вирусных инфекций. [7] Например, азидотимидин (AZT) является аналогом нуклеозида, используемым для профилактики и лечения ВИЧ/СПИДа . [8]
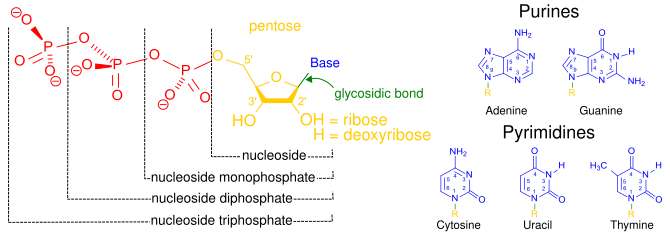
Термин нуклеозид относится к азотистому основанию , связанному с 5-углеродным сахаром ( рибозой или дезоксирибозой ). [1] Нуклеотиды — это нуклеозиды, ковалентно связанные с одной или несколькими фосфатными группами . [9] Чтобы предоставить информацию о количестве фосфатов, нуклеотиды могут называться нуклеозид (моно, ди или три) фосфатами. [10] Таким образом, нуклеозидтрифосфаты являются типом нуклеотидов. [10]
Нуклеотиды обычно сокращаются до 3 букв (4 или 5 в случае дезокси- или дидезокси-нуклеотидов). Первая буква указывает на идентичность азотистого основания (например, A для аденина , G для гуанина ), вторая буква указывает на количество фосфатов (моно, ди, три), а третья буква - P, обозначающая фосфат. [11] Нуклеозидтрифосфаты, содержащие рибозу в качестве сахара, обычно сокращаются до NTP, в то время как нуклеозидтрифосфаты, содержащие дезоксирибозу в качестве сахара , сокращаются до dNTP. Например, dATP обозначает дезоксирибоза-аденозинтрифосфат. NTP являются строительными блоками РНК , а dNTP являются строительными блоками ДНК . [12]
Атомы углерода сахара в нуклеозидтрифосфате пронумерованы вокруг углеродного кольца, начиная с исходного карбонила сахара. Обычно номера углерода в сахаре сопровождаются символом «штрих» ('), чтобы отличать их от атомов углерода азотистого основания. Азотистое основание связано с 1'-углеродом через гликозидную связь , а фосфатные группы ковалентно связаны с 5'-углеродом. [13] Первая фосфатная группа, связанная с сахаром, называется α-фосфатом, вторая — β-фосфатом, а третья — γ-фосфатом; они связаны друг с другом двумя фосфоангидридными связями. [14]

Клеточные процессы репликации и транскрипции ДНК включают синтез ДНК и РНК соответственно. Синтез ДНК использует dNTP в качестве субстратов, в то время как синтез РНК использует rNTP в качестве субстратов. [2] NTP не могут быть преобразованы напрямую в dNTP. ДНК содержит четыре различных азотистых основания: аденин , гуанин , цитозин и тимин . РНК также содержит аденин, гуанин и цитозин, но заменяет тимин урацилом . [15] Таким образом, синтез ДНК требует dATP, dGTP, dCTP и dTTP в качестве субстратов, в то время как синтез РНК требует АТФ, ГТФ, ЦТФ и УТФ.
Синтез нуклеиновых кислот катализируется либо ДНК-полимеразой , либо РНК-полимеразой для синтеза ДНК и РНК соответственно. [16] Эти ферменты ковалентно связывают свободную -ОН- группу на 3'-углероде растущей цепи нуклеотидов с α-фосфатом на 5'-углероде следующего (d)NTP, высвобождая β- и γ-фосфатные группы в виде пирофосфата (PP i ). [17] Это приводит к образованию фосфодиэфирной связи между двумя (d)NTP. Высвобождение PP i обеспечивает необходимую для реакции энергию. [17] Важно отметить, что синтез нуклеиновых кислот происходит исключительно в направлении от 5' к 3' .
Учитывая их важность в клетке, синтез и деградация нуклеозидтрифосфатов находятся под строгим контролем. [6] В этом разделе основное внимание уделяется метаболизму нуклеозидтрифосфатов у людей, но этот процесс довольно консервативен среди видов. [18] Нуклеозидтрифосфаты не могут хорошо усваиваться, поэтому все нуклеозидтрифосфаты обычно производятся de novo . [19] Синтез АТФ и ГТФ ( пуринов ) отличается от синтеза ЦТФ, ТТФ и УТФ ( пиримидинов ). Как синтез пуринов, так и синтез пиримидинов используют фосфорибозилпирофосфат (PRPP) в качестве исходной молекулы. [20]
Преобразование NTP в dNTP может быть осуществлено только в дифосфатной форме. Обычно NTP имеет один удаленный фосфат, чтобы стать NDP, затем преобразуется в dNDP ферментом, называемым рибонуклеотидредуктазой , затем фосфат добавляется обратно, чтобы получить dNTP. [21]
Азотистое основание, называемое гипоксантином , собирается непосредственно на PRPP. [22] Это приводит к образованию нуклеотида, называемого инозинмонофосфатом (ИМФ). Затем ИМФ преобразуется либо в предшественника АМФ, либо в ГМФ. После образования АМФ или ГМФ они могут быть фосфорилированы АТФ до их дифосфатной и трифосфатной форм. [23]
Синтез пуринов регулируется аллостерическим ингибированием образования ИМФ нуклеотидами аденина или гуанина. [24] АМФ и ГМФ также конкурентно ингибируют образование своих предшественников из ИМФ. [25]
Азотистое основание, называемое оротатом, синтезируется независимо от PRPP. [25] После того, как оротат образован, он ковалентно присоединяется к PRPP. Это приводит к образованию нуклеотида, называемого оротатмонофосфатом (OMP). [26] OMP преобразуется в UMP, который затем может быть фосфорилирован АТФ до UDP и UTP. Затем UTP может быть преобразован в CTP посредством реакции дезаминирования . [27] TTP не является субстратом для синтеза нуклеиновых кислот, поэтому он не синтезируется в клетке. Вместо этого dTTP производится косвенно либо из dUDP, либо из dCDP после преобразования в их соответствующие формы дезоксирибозы. [20]
Синтез пиримидина регулируется аллостерическим ингибированием синтеза оротата UDP и UTP. PRPP и ATP также являются аллостерическими активаторами синтеза оротата. [28]
Рибонуклеотидредуктаза (RNR) — это фермент, ответственный за преобразование NTP в dNTP. Учитывая, что dNTP используются в репликации ДНК, активность RNR строго регулируется. [6] Важно отметить, что RNR может обрабатывать только NDP, поэтому NTP сначала дефосфорилируются до NDP перед преобразованием в dNDP. [29] Затем dNDP обычно повторно фосфорилируются. RNR имеет 2 субъединицы и 3 сайта: каталитический сайт, сайт активности (A) и сайт специфичности (S). [29] Каталитический сайт — это место, где происходит реакция NDP в dNDP, сайт активности определяет, активен ли фермент, а сайт специфичности определяет, какая реакция происходит в каталитическом сайте.
Сайт активности может связывать либо АТФ, либо дАТФ. [30] При связывании с АТФ РНР активен. Когда АТФ или дАТФ связывается с сайтом S, РНР будет катализировать синтез дЦДФ и дУДФ из ЦДФ и УДФ. ДЦДФ и дУДФ могут продолжать косвенно производить дТТФ. ДТТФ, связанный с сайтом S, будет катализировать синтез дГДФ из ГДФ, а связывание дГДФ с сайтом S будет способствовать синтезу дАДФ из АДФ. [31] Затем дАДФ фосфорилируется с образованием дАТФ, который может связываться с сайтом А и выключать РНР. [30]

АТФ является основной энергетической валютой клетки. [32] Несмотря на то, что он синтезируется посредством описанного выше метаболического пути, он в первую очередь синтезируется как во время клеточного дыхания [33] , так и во время фотосинтеза [34] АТФ-синтазой . АТФ-синтаза связывает синтез АТФ из АДФ и фосфата с электрохимическим градиентом , создаваемым перекачкой протонов либо через внутреннюю митохондриальную мембрану (клеточное дыхание), либо через тилакоидную мембрану (фотосинтез). [35] Этот электрохимический градиент необходим, поскольку образование АТФ энергетически невыгодно .
Гидролиз АТФ до АДФ и P i протекает следующим образом: [36]
Эта реакция энергетически выгодна и высвобождает 30,5 кДж/моль энергии. [3] В клетке эта реакция часто сочетается с неблагоприятными реакциями, обеспечивая их энергией для протекания. [37] ГТФ иногда используется для энергетического сопряжения аналогичным образом. [38]

GTP необходим для передачи сигнала , особенно с G-белками . G-белки связаны с рецептором, связанным с клеточной мембраной. [4] Весь этот комплекс называется рецептором, связанным с G-белком (GPCR). G-белки могут связывать либо GDP, либо GTP. При связывании с GDP G-белки неактивны. Когда лиганд связывается с GPCR, запускается аллостерическое изменение в G-белке, в результате чего GDP покидает его и заменяется GTP. [39] GTP активирует альфа-субъединицу G-белка, заставляя его диссоциировать от G-белка и действовать как нисходящий эффектор. [39]
Аналоги нуклеозидов могут использоваться для лечения вирусных инфекций . [40] Аналоги нуклеозидов — это нуклеозиды, которые структурно похожи (аналогичны) на нуклеозиды, используемые в синтезе ДНК и РНК. [41] После того, как эти аналоги нуклеозидов попадают в клетку, они могут фосфорилироваться вирусным ферментом. Полученные нуклеотиды достаточно похожи на нуклеотиды, используемые в синтезе ДНК или РНК, чтобы быть включенными в растущие цепи ДНК или РНК, но у них нет доступной 3' ОН-группы для присоединения следующего нуклеотида, вызывая обрыв цепи . [42] Это может быть использовано для терапевтического использования при вирусных инфекциях, поскольку вирусная ДНК-полимераза распознает определенные аналоги нуклеотидов более легко, чем эукариотическая ДНК-полимераза. [40] Например, азидотимидин используется для лечения ВИЧ/СПИДа . [8] Некоторые менее селективные аналоги нуклеозидов могут использоваться в качестве химиотерапевтических агентов для лечения рака, [43] например, цитозин арабиноза (ara-C) при лечении некоторых форм лейкемии . [7]
Устойчивость к аналогам нуклеозидов встречается часто и часто возникает из-за мутации фермента, который фосфорилирует нуклеозид после попадания в клетку. [7] Это часто встречается в аналогах нуклеозидов, используемых для лечения ВИЧ/СПИДа. [44]