1-Пропанол (также пропан-1-ол , пропанол , н-пропиловый спирт ) — первичный спирт с формулой CH3CH2CH2OH и иногда представленный как PrOH или n - PrOH . Это бесцветная жидкость и изомер 2-пропанола . 1-Пропанол используется в качестве растворителя в фармацевтической промышленности, в основном для смол и эфиров целлюлозы , а также иногда как дезинфицирующее средство.
Сивушные спирты, такие как 1-пропанол, являются побочными продуктами ферментации зерна, поэтому следовые количества 1-пропанола присутствуют во многих алкогольных напитках .
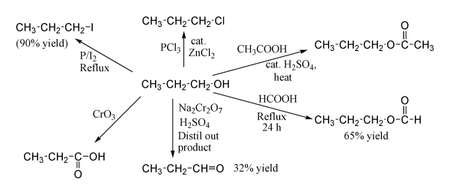
1-Пропанол демонстрирует нормальные реакции первичного спирта . Таким образом, его можно преобразовать в алкилгалогениды ; например, красный фосфор и йод дают н-пропилиодид с выходом 80%, в то время как PCl 3 с каталитическим ZnCl 2 дает н-пропилхлорид . Реакция с уксусной кислотой в присутствии катализатора H 2 SO 4 в условиях этерификации по Фишеру дает пропилацетат , в то время как кипячение пропанола в течение ночи с одной только муравьиной кислотой может дать пропилформиат с выходом 65%. Окисление 1-пропанола с Na 2 Cr 2 O 7 и H 2 SO 4 дает 36% выход пропионового альдегида , и поэтому для этого типа реакции рекомендуются методы с более высоким выходом, использующие PCC или окисление Сверна . Окисление хромовой кислотой дает пропионовую кислоту .
1-Пропанол производится путем каталитического гидрирования пропионового альдегида . Пропионовый альдегид производится посредством оксо-процесса путем гидроформилирования этилена с использованием оксида углерода и водорода в присутствии катализатора, такого как октакарбонил кобальта или родиевый комплекс. [5]
Традиционное лабораторное получение 1-пропанола включает обработку н - пропилиодида влажным Ag2O .
Считается, что 1-пропанол по своему воздействию на организм человека аналогичен этанолу , но в 2–4 раза более эффективен, согласно исследованию, проведенному на кроликах. Многие токсикологические исследования обнаружили, что пероральная острая LD 50 составляет от 1,9 г/кг до 6,5 г/кг (по сравнению с 7,06 г/кг для этанола). Он метаболизируется в пропионовую кислоту . Эффекты включают алкогольную интоксикацию и метаболический ацидоз с высоким анионным интервалом . По состоянию на 2011 год был зарегистрирован один случай смертельного отравления после перорального приема 500 мл 1-пропанола. [6] Из-за отсутствия долгосрочных данных канцерогенность 1-пропанола для людей неизвестна.
1-пропанол имеет высокое октановое число и подходит для использования в качестве моторного топлива. Однако пропанол слишком дорог для использования в качестве моторного топлива. Исследовательское октановое число (RON) пропанола составляет 118, а антидетонационный индекс (AKI) — 108. [7]