Оксид свинца(IV) , обычно известный как диоксид свинца , представляет собой неорганическое соединение с химической формулой PbO2 . Это оксид , в котором свинец находится в степени окисления +4. [1] Это темно-коричневое твердое вещество, нерастворимое в воде. [2] Он существует в двух кристаллических формах. Он имеет несколько важных применений в электрохимии , в частности в качестве положительной пластины свинцово-кислотных аккумуляторов .

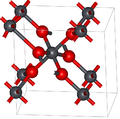
Диоксид свинца имеет два основных полиморфа, альфа и бета, которые встречаются в природе как редкие минералы скрутинит и платтнерит , соответственно. В то время как бета-форма была идентифицирована в 1845 году, [3] α -PbO 2 был впервые идентифицирован в 1946 году и обнаружен как природный минерал в 1988 году. [4]
Альфа-форма имеет орторомбическую симметрию, пространственную группу Pbcn (№ 60), символ Пирсона oP 12, постоянные решетки a = 0,497 нм, b = 0,596 нм, c = 0,544 нм, Z = 4 (четыре формульные единицы на элементарную ячейку). [4] Атомы свинца имеют шесть координат.
Симметрия бета-формы тетрагональная , пространственная группа P4 2 /mnm (№ 136), символ Пирсона tP 6, константы решетки a = 0,491 нм, c = 0,3385 нм, Z = 2 [5] и связана со структурой рутила и может рассматриваться как содержащая колонки октаэдров, имеющих общие противоположные ребра и соединенных с другими цепями углами. Это контрастирует с альфа-формой, где октаэдры соединены соседними ребрами, образуя зигзагообразные цепи. [4]
Диоксид свинца разлагается при нагревании на воздухе следующим образом:
Стехиометрию конечного продукта можно контролировать, изменяя температуру – например, в приведенной выше реакции первая стадия происходит при 290 °C, вторая при 350 °C, третья при 375 °C и четвертая при 600 °C. Кроме того, Pb2O3 можно получить путем разложения PbO2 при 580–620 ° C под давлением кислорода 1400 атм (140 МПа). Поэтому термическое разложение диоксида свинца является распространенным способом получения различных оксидов свинца. [6]
Диоксид свинца — амфотерное соединение с преобладающими кислотными свойствами. Он растворяется в сильных основаниях , образуя гидроксиплюмбат - ион [Pb(OH) 6 ] 2− : [2]
Он также реагирует с основными оксидами в расплаве, образуя ортоплюмбаты M 4 [PbO 4 ] .
Из-за нестабильности катиона Pb4 + диоксид свинца реагирует с горячими кислотами, переходя в более стабильное состояние Pb2 + и выделяя кислород: [6]
Однако эти реакции медленные.
Диоксид свинца хорошо известен как хороший окислитель , примеры реакций приведены ниже: [7]
Хотя формула диоксида свинца номинально дана как PbO 2 , фактическое соотношение кислорода к свинцу варьируется от 1,90 до 1,98 в зависимости от метода приготовления. Дефицит кислорода (или избыток свинца) приводит к характерной металлической проводимости диоксида свинца с удельным сопротивлением всего 10 −4 Ом·см, что используется в различных электрохимических приложениях. Как и металлы, диоксид свинца имеет характерный электродный потенциал , и в электролитах он может быть поляризован как анодно, так и катодно . Электроды из диоксида свинца имеют двойное действие, то есть ионы свинца и кислорода принимают участие в электрохимических реакциях. [8]
Диоксид свинца производится в промышленных масштабах несколькими способами, включая окисление свинцового сурика ( Pb 3 O 4 ) в щелочной суспензии в атмосфере хлора, [6] реакцию ацетата свинца (II) с «хлорной известью» ( гипохлоритом кальция ), [9] [10] Реакция Pb 3 O 4 с азотной кислотой также дает диоксид: [2] [11]
PbO 2 реагирует с гидроксидом натрия с образованием иона гексагидроксоплюмбата(IV) [Pb(OH) 6 ] 2− , растворимого в воде.
Альтернативный метод синтеза — электрохимический : диоксид свинца образуется на чистом свинце в разбавленной серной кислоте при анодной поляризации при электродном потенциале около +1,5 В при комнатной температуре. Эта процедура используется для крупномасштабного промышленного производства анодов PbO 2 . Свинцовые и медные электроды погружают в серную кислоту, текущую со скоростью 5–10 л/мин. Электроосаждение проводят гальваностатически , прикладывая ток около 100 А/м 2 в течение примерно 30 минут.
Недостатком этого метода производства анодов из диоксида свинца является его мягкость, особенно по сравнению с твердым и хрупким PbO 2 , твердость которого по шкале Мооса составляет 5,5. [12] Это несоответствие механических свойств приводит к отслаиванию покрытия, которое является предпочтительным для массового производства PbO 2. Поэтому альтернативным методом является использование более твердых подложек, таких как титан , ниобий , тантал или графит , и осаждение на них PbO 2 из нитрата свинца (II) в статической или проточной азотной кислоте. Подложку обычно подвергают пескоструйной обработке перед осаждением для удаления поверхностного оксида и загрязнений, а также для увеличения шероховатости поверхности и адгезии покрытия. [13]
Диоксид свинца используется в производстве спичек , пиротехники , красителей и отверждения сульфидных полимеров . Он также используется в строительстве высоковольтных молниеотводов . [6]
Диоксид свинца используется в качестве анодного материала в электрохимии. β- PbO2 более привлекателен для этой цели, чем α-форма, поскольку имеет относительно низкое удельное сопротивление , хорошую коррозионную стойкость даже в среде с низким pH и высокое перенапряжение для выделения кислорода в электролитах на основе серной и азотной кислоты. Диоксид свинца также может выдерживать выделение хлора в соляной кислоте . Аноды из диоксида свинца недороги и когда-то использовались вместо обычных платиновых и графитовых электродов для регенерации дихромата калия . Они также применялись в качестве кислородных анодов для гальванопокрытия меди и цинка в сульфатных ваннах. В органическом синтезе аноды из диоксида свинца применялись для получения глиоксиловой кислоты из щавелевой кислоты в электролите серной кислоты. [13]
Наиболее важным применением диоксида свинца является его использование в качестве катода свинцово-кислотных аккумуляторов . Его полезность обусловлена аномальной металлической проводимостью PbO 2 . Свинцово-кислотный аккумулятор хранит и высвобождает энергию, изменяя равновесие (соотношение) между металлическим свинцом, диоксидом свинца и солями свинца (II) в серной кислоте .
Соединения свинца являются ядами . Хронический контакт с кожей может потенциально вызвать отравление свинцом через всасывание или покраснение и раздражение в краткосрочной перспективе. [14]
PbO 2 не горюч, но усиливает воспламеняемость других веществ и интенсивность огня. В случае пожара выделяет раздражающие и токсичные пары. [15] [ нужен лучший источник ]
Диоксид свинца ядовит для водных организмов, но из-за своей нерастворимости он обычно оседает из воды. [16] [15]
{{cite web}}: CS1 maint: неподходящий URL ( ссылка )