Оогенез ( / ˌ oʊ . ə ˈ dʒ ɛ n ɪ s ɪ s / ) или овогенез — это дифференциация яйцеклетки ( яйцеклетки) в клетку, способную к дальнейшему развитию при оплодотворении. [1] Она развивается из первичного ооцита путем созревания. Оогенез начинается на эмбриональной стадии.
У млекопитающих первая часть оогенеза начинается в зародышевом эпителии , что приводит к развитию овариальных фолликулов — функциональной единицы яичника .
Оогенез состоит из нескольких подпроцессов: ооцитогенез , оотидогенез и, наконец, созревание с образованием яйцеклетки (собственно оогенез). Фолликулогенез — это отдельный подпроцесс, который сопровождает и поддерживает все три оогенетических подпроцесса.
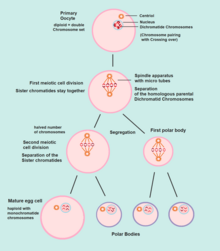
Оогоний — (Ооцитогенез) —> Первичный ооцит — (Мейоз I) —> Первое полярное тельце (впоследствии отбрасывается) + Вторичный ооцит — (Мейоз II) —> Второе полярное тельце (впоследствии отбрасывается) + Яйцеклетка
Мейоз ооцитов, важный для всех жизненных циклов животных, однако в отличие от всех других случаев деления животных клеток, происходит полностью без помощи координирующих веретено центросом . [2] [3]
Создание оогоний традиционно не относится к собственно оогенезу, а, вместо этого, к общему процессу гаметогенеза , который у женщин начинается с процессов фолликулогенеза , ооцитогенеза и оотидогенеза . Оогонии вступают в мейоз во время эмбрионального развития, становясь ооцитами. Мейоз начинается с репликации ДНК и мейотического кроссинговера. Затем он останавливается в ранней профазе.
Ооциты млекопитающих поддерживаются в состоянии остановки мейотической профазы в течение очень долгого времени — месяцы у мышей и годы у людей. Первоначально остановка происходит из-за отсутствия достаточного количества белков клеточного цикла для мейотической прогрессии. Однако по мере роста ооцита эти белки синтезируются, и остановка мейоза становится зависимой от циклического АМФ . [4] Циклический АМФ вырабатывается ооцитом аденилатциклазой в мембране ооцита. Аденилатциклаза поддерживается активной конститутивно активным рецептором, связанным с G-белком, известным как GPR3 , и G-белком, Gs, также присутствующим в мембране ооцита. [5]
Поддержание мейотического ареста также зависит от наличия многослойного комплекса клеток, известного как фолликул, который окружает ооцит. Удаление ооцита из фолликула вызывает прогрессирование мейоза в ооците. [6] Клетки, составляющие фолликул, известные как гранулезные клетки, соединены друг с другом белками, известными как щелевые контакты, которые позволяют небольшим молекулам проходить между клетками. Гранулезные клетки вырабатывают небольшую молекулу, циклический ГМФ , которая диффундирует в ооцит через щелевые контакты. В ооците циклический ГМФ предотвращает расщепление циклического АМФ фосфодиэстеразой PDE3 и, таким образом, поддерживает мейотический арест. [7] Циклический ГМФ вырабатывается гуанилатциклазой NPR2. [8]
По мере роста фолликулов они приобретают рецепторы для лютеинизирующего гормона, гормона гипофиза, который повторно инициирует мейоз в ооците и вызывает овуляцию оплодотворяемой яйцеклетки. Лютеинизирующий гормон действует на рецепторы во внешних слоях гранулезных клеток фолликула, вызывая снижение циклического ГМФ в гранулезных клетках. [4] Поскольку гранулезные клетки и ооцит соединены щелевыми контактами, циклический ГМФ также снижается в ооците, заставляя мейоз возобновляться. [9] Затем мейоз переходит ко второй метафазе, где он снова останавливается до оплодотворения. Лютеинизирующий гормон также стимулирует экспрессию генов, приводящую к овуляции. [10]



Оогенез начинается с процесса развития первичных ооцитов, который происходит посредством трансформации оогоний в первичные [ооциты], процесс, называемый ооцитогенезом . [11] Из одного единственного оогония вырастет только один зрелый ооцит с тремя другими клетками, называемыми полярными тельцами. Ооцитогенез завершается либо до, либо вскоре после рождения.
Обычно считается, что, когда ооцитогенез завершен, никаких дополнительных первичных ооцитов не создается, в отличие от мужского процесса сперматогенеза, где гаметоциты создаются непрерывно. Другими словами, первичные ооциты достигают своего максимального развития примерно на 20 неделе гестационного возраста, когда создается около семи миллионов первичных ооцитов; однако при рождении это число уже сокращается примерно до 1-2 миллионов на яичник. В период полового созревания количество ооцитов уменьшается еще больше и достигает примерно 60 000-80 000 на яичник, и только около 500 зрелых ооцитов будут произведены в течение жизни женщины, остальные подвергнутся атрезии (дегенерации). [12] Две публикации подвергли сомнению убеждение в том, что конечное число ооцитов устанавливается примерно во время генерации рождения в яичниках взрослых млекопитающих предполагаемыми зародышевыми клетками в костном мозге и периферической крови. [13] [14] Обновление фолликулов яичников из стволовых клеток зародышевой линии (происходящих из костного мозга и периферической крови) было отмечено в постнатальном яичнике мыши. Напротив, измерения ДНК-часов не указывают на продолжающийся оогенез в течение жизни человеческих женщин. [15] Таким образом, необходимы дальнейшие эксперименты для определения истинной динамики формирования малых фолликулов.
Последующая фаза оотидогенеза происходит, когда первичный ооцит развивается в оотиду . Это достигается в процессе мейоза. Фактически, первичный ооцит, по своему биологическому определению, является клеткой, чьей основной функцией является деление в процессе мейоза. [16]
Однако, хотя этот процесс начинается в пренатальном возрасте, он останавливается в профазе I. В конце фетальной жизни все ооциты, все еще первичные ооциты, останавливаются на этой стадии развития, называемой диктиатом . После менархе эти клетки продолжают развиваться, хотя лишь немногие делают это каждый менструальный цикл .
Мейоз I оотидогенеза начинается во время эмбрионального развития, но останавливается на стадии диплотены профазы I до полового созревания. Ооцит мыши на стадии диктиата (длительной диплотены) активно восстанавливает повреждения ДНК, тогда как на стадиях предиктиата ( лептотена , зиготена и пахитена ) мейоза восстановление ДНК не обнаруживается. [17] Однако для тех первичных ооцитов, которые продолжают развиваться в каждом менструальном цикле, происходит синапсис и образуются тетрады , что позволяет происходить хромосомному кроссинговеру . В результате мейоза I первичный ооцит теперь развился во вторичный ооцит .
Сразу после мейоза I гаплоидный вторичный ооцит инициирует мейоз II . Однако этот процесс также останавливается на стадии метафазы II до оплодотворения , если таковое когда-либо произойдет. Если яйцеклетка не оплодотворена, она распадается и высвобождается ( менструация ), а вторичный ооцит не завершает мейоз II (и не становится яйцеклеткой ) . Когда мейоз II завершается, создаются яйцеклетка и еще одно полярное тельце. Полярное тельце имеет небольшой размер.
Овариальный цикл делится на несколько фаз:
Маточный цикл [20] происходит параллельно овариальному циклу и индуцируется эстрогеном и прогестероном. Эндометрий , образованный моностратифицированным цилиндрическим эпителием с маточными железами (простыми трубчатыми), соединенными с функциональным поверхностным слоем (разделенным на губчатый слой, компактный слой и более глубокий базальный слой, который всегда сохраняется), представляет четыре фазы:
Если же вместо этого происходит оплодотворение, слизистая оболочка матки модифицируется, чтобы принять оплодотворенную яйцеклетку, и секреторная фаза сохраняется.
Оба полярных тельца распадаются в конце мейоза II, оставляя только яйцеклетку, которая затем в конечном итоге созревает в зрелую яйцеклетку.
Функция формирования полярных телец заключается в отбрасывании дополнительных гаплоидных наборов хромосом, которые образовались в результате мейоза.
Созревание in vitro ( IVM ) — это метод, позволяющий фолликулам яичников созреть in vitro . Потенциально его можно проводить перед ЭКО . В таких случаях гиперстимуляция яичников не является обязательной. Напротив, ооциты могут созревать вне организма до ЭКО. Следовательно, в организм не нужно вводить гонадотропины (или, по крайней мере, вводить их в меньших дозах). [21] Незрелые яйцеклетки выращивались до созревания in vitro с 10%-ным коэффициентом выживаемости, но этот метод пока не доступен клинически. [22] С помощью этого метода криоконсервированную ткань яичников можно было бы использовать для создания ооцитов, которые могут напрямую подвергаться оплодотворению in vitro . [22]
По определению это означает повторение оогенеза млекопитающих и получение оплодотворяемых ооцитов in vitro. Это сложный процесс, включающий несколько различных типов клеток, точные взаимные взаимодействия фолликулярных клеток и ооцитов, различные питательные вещества и комбинации цитокинов, а также точные факторы роста и гормоны в зависимости от стадии развития. [23] В 2016 году в двух статьях, опубликованных Морохаку и др. и Хикабе и др., сообщалось о процедурах in vitro, которые, по-видимому, эффективно воспроизводят эти условия, позволяя производить полностью в чашке Петри относительно большое количество ооцитов, которые оплодотворяемы и способны дать начало жизнеспособному потомству у мышей. Этот метод может быть в основном полезен для онкологических пациентов, у которых в сегодняшнем состоянии их ткань яичников криоконсервируется для сохранения фертильности. В качестве альтернативы аутологичной трансплантации разработка систем культивирования, которые поддерживают развитие ооцитов со стадии первичного фолликула, представляет собой действенную стратегию восстановления фертильности. Со временем было проведено множество исследований с целью оптимизации характеристик систем культивирования тканей яичников и лучшей поддержки трех основных фаз: 1) активация примордиальных фолликулов; 2) изоляция и культивирование растущих преантральных фолликулов; 3) удаление из среды фолликулов и созревание комплексов кумулюса ооцитов. В то время как полное развитие ооцитов in vitro было достигнуто у мышей с получением живого потомства, цель получения ооцитов достаточного качества для поддержки развития эмбриона не была полностью достигнута у высших млекопитающих, несмотря на десятилетия усилий. [24]
Белки BRCA1 и ATM используются для восстановления двухцепочечных разрывов ДНК во время мейоза . Эти белки, по-видимому, играют решающую роль в сопротивлении старению яичников . [25] Однако гомологичная рекомбинационная репарация двухцепочечных разрывов ДНК, опосредованная BRCA1 и ATM, ослабевает с возрастом в ооцитах людей и других видов. [25] Женщины с мутациями BRCA1 имеют более низкие резервы яичников и испытывают более раннюю менопаузу, чем женщины без этих мутаций. Даже у женщин без специфических мутаций BRCA1 старение яичников связано с истощением резервов яичников, что приводит к менопаузе, но более медленными темпами, чем у женщин с такими мутациями. Поскольку у пожилых женщин в пременопаузе обычно нормальное потомство, их способность к мейотической рекомбинационной репарации, по-видимому, достаточна для предотвращения ухудшения их зародышевой линии, несмотря на сокращение резерва яичников. Повреждения ДНК могут возникать в зародышевой линии в течение десятилетий длительного периода у людей между ранним ооцитогенезом и стадией мейоза, на которой гомологичные хромосомы эффективно спариваются ( стадия диктиата ). Было высказано предположение, что такие повреждения ДНК могут быть устранены, в значительной степени, механизмами, зависящими от спаривания хромосом, такими как гомологичная рекомбинация. [26]

Некоторые водоросли и оомицеты производят яйца в оогониях . У бурой водоросли Fucus все четыре яйцеклетки выживают в оогенезе, что является исключением из правила, согласно которому обычно только один продукт женского мейоза доживает до зрелости.
У растений оогенез происходит внутри женского гаметофита посредством митоза . У многих растений, таких как мохообразные , папоротники и голосеменные , яйцеклетки образуются в архегониях . У цветковых растений женский гаметофит был редуцирован до восьмиклеточного зародышевого мешка внутри семяпочки внутри завязи цветка. Оогенез происходит внутри зародышевого мешка и приводит к образованию одной яйцеклетки на семяпочку.
У аскарид ооцит даже не начинает мейоз, пока к нему не прикоснется сперматозоид , в отличие от млекопитающих, у которых мейоз завершается в течение эстрального цикла.
У самок мух Drosophila генетическая рекомбинация происходит во время мейоза . Эта рекомбинация связана с образованием двухцепочечных разрывов ДНК и их восстановлением . [27] Процесс восстановления приводит к образованию кроссоверных рекомбинантов, а также по крайней мере в три раза большего количества некроссоверных рекомбинантов (например, возникающих в результате генной конверсии без кроссинговера). [27]
Cho WK, Stern S, Biggers JD. 1974. Ингибирующее действие дибутирил цАМФ на созревание ооцитов мышей in vitro. J Exp Zool.187:383-386
{{cite journal}}: Цитировать журнал требует |journal=( помощь )