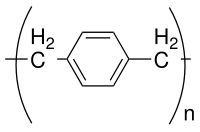

Парилен — общее название полимера , основная цепь которого состоит из пара - бензолдиильных колец − C
6ЧАС
4− соединены 1,2-этандиильными мостиками − CH
2− Ч.
2−. Его можно получить полимеризацией параксилилена H
2С = С
6ЧАС
4= Ч
2.
Название также используется для нескольких полимеров с той же основной цепью, где некоторые атомы водорода заменены другими функциональными группами . Некоторые из этих вариантов обозначаются в торговле буквенно-цифровыми кодами, такими как «parylene C» и «parylene AF-4». Некоторые из этих названий являются зарегистрированными торговыми марками в некоторых странах.
Покрытия из парилена часто наносятся на электронные схемы и другое оборудование в качестве электроизоляции , барьеров для влаги или защиты от коррозии и химического воздействия ( конформное покрытие ). Они также используются для снижения трения и в медицине для предотвращения побочных реакций на имплантированные устройства . Эти покрытия обычно наносятся методом химического осаждения из паровой фазы в атмосфере мономера параксилилена .
Парилен считается «зеленым» полимером , поскольку для его полимеризации не требуется инициатора или других химикатов для обрыва цепи; а покрытия можно наносить при комнатной температуре или близкой к ней, без какого-либо растворителя .
Парилен был открыт в 1947 году Михаэлем Шварцем как один из продуктов термического разложения параксилола H
3С − С
6ЧАС
4− Ч.
3выше 1000 °C. Шварц идентифицировал параксилилен как предшественник, наблюдая, что реакция с йодом дала параксилилендииодид в качестве единственного продукта. Выход реакции составил всего несколько процентов. [1] [2]
Более эффективный путь был найден в 1965 году Уильямом Ф. Горхэмом из Union Carbide. Он наносил париленовые пленки путем термического разложения [2.2]парациклофана при температурах выше 550 °C и в вакууме ниже 1 Торр. Этот процесс не требовал растворителя и приводил к химически стойким пленкам без пор. Union Carbide коммерциализировала систему париленового покрытия в 1965 году. [1] [2]
Union Carbide продолжила проводить исследования по синтезу многочисленных прекурсоров парилена, включая парилен AF-4, в течение 1960-х и до начала 1970-х годов. Union Carbide приобрела NovaTran (производитель париленовых покрытий) в 1984 году и объединила его с другими предприятиями по производству электронных химических покрытий, чтобы сформировать подразделение Specialty Coating Systems. Подразделение было продано Cookson Electronics в 1994 году. [3]
По всему миру существуют компании по обслуживанию покрытий парилена, но коммерческая доступность парилена ограничена. Прекурсоры [2,2]парациклофана можно приобрести для парилена N, C, D, AF-4 и VT-4. Услуги по парилену предоставляются для N, C, AF-4, VT-4 и E (сополимер N и E).
Парилен N — незамещенный полимер, полученный путем полимеризации промежуточного продукта параксилилена .

Производные парилена могут быть получены путем замены атомов водорода в фенильном кольце или алифатическом мостике другими функциональными группами. Наиболее распространенным из этих вариантов является парилен C, в котором один атом водорода в арильном кольце заменен на хлор . Другим распространенным вариантом является парилен D, с двумя такими заменами в кольце.
Парилен C является наиболее используемым сортом из-за низкой стоимости его предшественника и баланса его свойств как диэлектрика и барьера для влаги и простоты нанесения. Основным недостатком для многих применений является его нерастворимость в любом растворителе при комнатной температуре, что препятствует удалению покрытия, когда деталь должна быть переработана.
Парилен С также является наиболее часто используемым из-за его относительно низкой стоимости. [4] Его можно наносить при комнатной температуре, сохраняя при этом высокую степень конформности и однородности, а также умеренную скорость осаждения в периодическом процессе.
Кроме того, хлор в фенильном кольце повторяющегося звена парилена C является проблематичным для соответствия RoHS , особенно для производства печатных плат . Более того, часть димерного предшественника разлагается путем разрыва связи арил-хлор во время пиролиза, образуя углеродистый материал, загрязняющий покрытие, и хлористый водород HCl , который может повредить вакуумные насосы и другое оборудование. Атом хлора покидает фенильное кольцо в пиролизной трубке при всех температурах; однако оптимизация температуры пиролиза сведет эту проблему к минимуму. Свободный радикал (фенильный радикал), образующийся в этом процессе, не стабилизируется резонансом и смягчает отложение материала, похожего на парилен, на нижней стороне пиролизной трубки. Этот материал обугливается и генерирует частицы in situ, загрязняя чистые помещения и создавая дефекты на печатных платах, которые часто называют «стрингерами и узелками». Парилен N и E не имеют этой проблемы и поэтому предпочтительны для производства и использования в чистых помещениях.
Другой распространенный галогенированный вариант — парилен AF-4, в котором четыре атома водорода в алифатической цепи заменены атомами фтора . Этот вариант также продается под торговыми наименованиями парилен SF (Kisco) и HT парилен (SCS). − CF
2− единица, которая включает этиленовую цепь, такая же, как повторяющаяся единица PTFE (тефлона), что соответствует его превосходной окислительной и УФ-стабильности. Парилен AF-4 успешно используется для защиты наружных светодиодных дисплеев и освещения от воды, соли и загрязняющих веществ.
Другой фторированный вариант — парилен VT-4 (также называемый парилен F), в котором четыре водорода на арильном кольце заменены фтором. Этот вариант продается компанией Kisco под торговой маркой Parylene CF. Из-за алифатических −CH 2 − звеньев он имеет плохую окислительную и УФ-стабильность, но все же лучше, чем N, C или D.
Атомы водорода могут быть также замещены алкильными группами . Замещение может происходить либо по фенильному кольцу, либо по этиленовому мостику, либо по обоим.
В частности, замена одного водорода в фенильном кольце на метильную или этильную группу дает парилен М и Е соответственно.
Эти замены увеличивают межмолекулярное (цепь-цепь) расстояние, что делает полимер более растворимым и проницаемым. Например, по сравнению с париленом C, было показано, что парилен M имеет более низкую диэлектрическую постоянную (2,48 против 3,2 при 1 кГц ). Парилен E имел более низкий модуль упругости при растяжении ( 175 кПа против 460 кПа [ уточнить ] ), более низкую диэлектрическую постоянную (2,34 против 3,05 при 10 кГц), немного худшие свойства барьера для влаги (4,1 против 0,6 г-мил/атом-100 дюймов2-24 часа [ уточнить ] ) и эквивалентный диэлектрический пробой 5–6 кВ/ мил для покрытия толщиной 1 мил), но лучшую растворимость. [5] [6] Однако сополимер парилена N и E имеет эквивалентные барьерные характеристики парилена C.
Замена одного водорода на метил на каждом углероде этильного мостика дает парилен AM-2, [−(CH
3)СН−(С
6ЧАС
4)−(СН
3)Ч−]
н(не путать с аминозамещенным вариантом, зарегистрированным под торговой маркой Kisco). Растворимость парилена AM-2 не такая хорошая, как у парилена E.
Хотя париленовые покрытия в основном используются для защиты объекта от воды и других химикатов, в некоторых случаях требуется покрытие, способное связываться с клеями или другими покрытыми деталями или иммобилизовать различные молекулы, такие как красители, катализаторы или ферменты.
Эти «реактивные» покрытия парилена могут быть получены с химически активными заместителями. Два коммерчески доступных продукта — это парилен А, имеющий один аминовый заместитель − NH
2в каждой единице, и парилен AM, с одной метиленовой аминогруппой − CH
2Нью-Гэмпшир
2за единицу. Оба являются торговыми марками Kisco.
Парилен AM более реакционноспособен, чем вариант A. Амин последнего, будучи смежным с фенильным кольцом, находится в резонансной стабилизации и, следовательно, менее основный. Однако парилен A гораздо проще синтезировать и, следовательно, он дешевле.
Другой реакционноспособный вариант — парилен X, в котором к фенильному кольцу в некоторых единицах присоединена этинильная группа − C≡CH . Этот вариант, не содержащий других элементов, кроме водорода и углерода, может быть сшит под действием тепла или ультрафиолетового света и может реагировать с солями меди или серебра , образуя соответствующие металлоорганические комплексы Cu-ацетилид или Ag-ацетилид . Он также может подвергаться « химии щелчков » и может использоваться в качестве адгезива , позволяя связывать парилен-парилен без каких-либо побочных продуктов во время обработки. В отличие от большинства других вариантов, парилен X является аморфным (некристаллическим).
Можно присоединить хромофор непосредственно к молекуле основания [2.2]парациклофана, чтобы придать цвет парилену. [ необходима цитата ]
Сополимеры [7] и нанокомпозиты (SiO 2 /parylene C) [8] парилена ранее были осаждены при температуре, близкой к комнатной. С сильно электроноакцепторными сомономерами парилен может быть использован в качестве инициатора для инициирования полимеризации, например, с N-фенилмалеимидом . Используя нанокомпозиты парилен C/SiO 2 , парилен C может быть использован в качестве жертвенного слоя для изготовления тонких пленок нанопористого диоксида кремния с пористостью >90%. [9]
Тонкие пленки и покрытия из парилена прозрачны; однако они не являются аморфными, за исключением алкилированных париленов, т. е. парилена E. В результате того, что покрытия являются полукристаллическими, они рассеивают свет. Парилен N и C имеют низкую степень кристалличности; однако парилен VT-4 и AF-4 являются высококристаллическими ~60% в их состоянии после осаждения (гексагональная кристаллическая структура) и поэтому обычно не подходят в качестве оптических материалов.
Парилен С станет более кристаллическим, если его нагреть при повышенных температурах до точки плавления 270 °C.
Парилен N имеет моноклинную кристаллическую структуру в состоянии осаждения и не становится заметно более кристаллическим, пока не претерпит кристаллографическое фазовое превращение при ~220 °C в гексагональную, в этой точке он становится высококристаллическим, как фторированные парилены. Он может достигать 80% кристалличности при температурах отжига до 400 °C, после чего он деградирует.
Парилены относительно гибкие (0,5 ГПа для парилена N), [10] за исключением сшитого парилена X (1,0 ГПа), [11] и имеют плохую окислительную стойкость (~60–100 °C, в зависимости от критериев отказа) и УФ-стабильность, [12] за исключением парилена AF-4. Однако парилен AF-4 более дорогой из-за трехэтапного синтеза его предшественника с низким выходом и плохой эффективностью осаждения. Их УФ-стабильность настолько плоха, что парилен не может подвергаться воздействию обычного солнечного света без пожелтения.
Почти все парилены нерастворимы при комнатной температуре, за исключением алкилированных париленов, одним из которых является парилен E, [6] и алкилированных этинилпариленов. [13] Эта недостаточная растворимость затрудняет повторную обработку печатных плат, покрытых париленом.
В качестве барьера для диффузии влаги эффективность галогенированных париленовых покрытий нелинейно масштабируется с их плотностью. Атомы галогенов, такие как F, Cl и Br, добавляют большую плотность покрытию и, следовательно, позволяют покрытию быть лучшим барьером для диффузии; однако, если парилены используются в качестве барьера для диффузии воды, то неполярные химические вещества, такие как парилен E, намного эффективнее. Для барьеров для влаги необходимо оптимизировать три основных параметра материала: плотность покрытия, полярность покрытия (лучше всего подходит олефиновая химия) и температура стеклования выше комнатной температуры и, в идеале, выше предела службы печатной платы, устройства или детали. В этом отношении парилен E является наилучшим выбором, хотя он имеет низкую плотность по сравнению, например, с париленом C.
Париленовые покрытия обычно наносятся методом химического осаждения из паровой фазы в атмосфере мономера параксилилена или его производного. Этот метод имеет одно очень сильное преимущество, а именно, он не генерирует никаких побочных продуктов, кроме париленового полимера, который необходимо удалять из реакционной камеры и который может помешать полимеризации.
Детали, на которые наносится покрытие, должны быть чистыми, чтобы обеспечить хорошее прилипание пленки. Поскольку мономер диффундирует, области, которые не подлежат покрытию, должны быть герметично закрыты, без зазоров, щелей или других отверстий. Деталь должна находиться в относительно узком диапазоне давления и температуры. [15]
Процесс включает три этапа: образование газообразного мономера, адсорбцию на поверхности детали и полимеризацию адсорбированной пленки.
Полимеризация адсорбированного мономера п -ксилилена требует минимальной пороговой температуры. Для парилена N ее пороговая температура составляет 40 °C.
Промежуточный продукт p -ксилилена имеет два квантово-механических состояния: бензоидное состояние (триплетное состояние) и хиноидное состояние (синглетное состояние). Триплетное состояние фактически является инициатором, а синглетное состояние фактически является мономером. Триплетное состояние может быть дезактивировано при контакте с переходными металлами или оксидами металлов, включая Cu/CuO x . [16] [17] Многие из париленов проявляют эту селективность, основанную на квантово-механической дезактивации триплетного состояния, включая парилен X.
Полимеризация может протекать различными путями, которые отличаются временным обрывом растущих цепей, например, радикальной группой − CH•
2или отрицательная анион группа CH−
2:

Мономер полимеризуется только после того, как он физически адсорбируется ( физисорбируется ) на поверхности детали. Этот процесс имеет обратную кинетику Аррениуса , что означает, что он сильнее при более низких температурах, чем при более высоких. Существует критическая пороговая температура, выше которой практически нет физисорбции, и, следовательно, нет осаждения. Чем ближе температура осаждения к пороговой температуре, тем слабее физисорбция. Парилен С имеет более высокую пороговую температуру, 90 °C, и, следовательно, имеет гораздо более высокую скорость осаждения, более 1 нм / с, при этом все еще давая довольно однородные покрытия. [4] Напротив, пороговая температура парилена AF-4 очень близка к комнатной температуре (30–35 °C), в результате чего его эффективность осаждения низкая. [18]
Важным свойством мономера является так называемый «коэффициент прилипания», который выражает степень его адсорбции на полимере. Более низкий коэффициент приводит к более равномерной толщине осаждения и более конформному покрытию.
Другим важным свойством для процесса осаждения является поляризуемость, которая определяет, насколько сильно мономер взаимодействует с поверхностью. Осаждение галогенированных париленов сильно коррелирует с молекулярной массой мономера. Фторированные варианты являются исключением: поляризуемость парилена AF-4 низкая, что приводит к неэффективному осаждению.
Мономер п -ксилилен обычно образуется в процессе нанесения покрытия путем испарения циклического димера [2.2] пара - циклофана при относительно низкой температуре, а затем разложения пара при 450–700 °C и давлении 0,01–1,0 Торр . Этот метод (процесс Горхэма) дает 100% мономера без побочных продуктов или разложения мономера. [19] [20] [21]
Димер может быть синтезирован из п -ксилола, включающего несколько стадий, включая бромирование , аминирование и элиминирование Хофмана . [22]
Тот же метод может быть использован для осаждения замещенных париленов. Например, парилен C может быть получен из димерного предшественника дихлоро[2.2] пара -циклофана , за исключением того, что температура должна тщательно контролироваться, поскольку связь хлора с арильным атомом разрывается при 680 °C.
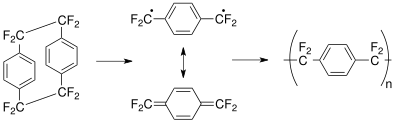
Стандартный процесс Горхэма [5] показан выше для парилена AF-4. Димер предшественника октафторо[2.2] пара -циклофана может быть сублимирован ниже <100 °C и расщеплён при 700–750 °C, что выше температуры (680 °C), используемой для расщеплённого незамещенного циклофана, поскольку связь −CF 2 −CF 2 − сильнее связи −CH 2 −CH 2 −. Этот резонансно-стабилизированный интермедиат транспортируется в камеру осаждения при комнатной температуре, где полимеризация происходит в условиях низкого давления (1–100 мТорр). [18]
Другой путь получения мономера заключается в использовании предшественника параксилола с подходящим заместителем на каждой метильной группе , удаление которой приводит к образованию параксилола .
Выбор уходящей группы может учитывать ее токсичность (что исключает реакции на основе серы и амина), насколько легко она покидает предшественника и возможное вмешательство в полимеризацию. Уходящая группа может быть либо захвачена перед камерой осаждения, либо она может быть очень летучей, чтобы не конденсироваться в последней. [23]
Например, предшественник α,α'-дибром-α,α,α',α'-тетрафтор- пара -ксилол (CF
2Бр)
2(С)
6ЧАС
4) дает парилен AF-4 с удалением брома . [24]
Преимуществом этого процесса является низкая стоимость синтеза прекурсора. Прекурсор также является жидкостью и может быть доставлен стандартными методами, разработанными в полупроводниковой промышленности, такими как испаритель, испаритель с барботером или контроллер массового расхода. Первоначально прекурсор был просто термически расщеплен, [25] но подходящие катализаторы снижают температуру пиролиза, что приводит к меньшему количеству остатка угля и лучшему покрытию. [26] [27] При любом методе из каждого метильного конца выделяется атомарный свободный радикал брома, который может быть преобразован в бромистый водород HBr и удален из потока мономера. Необходимы особые меры предосторожности, поскольку бром и HBr токсичны и едки по отношению к большинству металлов и металлических сплавов, а бром может повредить уплотнительные кольца Viton .

Аналогичный синтез для парилена N использует предшественник α,α'-диметокси-п-ксилол. [28 ] Метоксигруппа H
3CO − является уходящей группой; пока она конденсируется в камере осаждения, она не мешает осаждению полимера. [23] Этот прекурсор намного дешевле, чем [2.2] парациклофан . Более того, будучи жидкостью чуть выше комнатной температуры, этот прекурсор может надежно доставляться с помощью контроллера массового расхода ; тогда как генерация и доставка газообразного мономера процесса Горхэма трудно поддаются измерению и контролю. [29]

Тот же химический процесс может генерировать парилен АМ-2, который может быть получен из предшественника α,α'-диметил-α,α'-диметокси- п- ксилола.

Другим примером такого подхода является синтез парилена AF-4 из α,α'-дифенокси-α,α,α',α'-тетрафтор- пара -ксилола. В этом случае уходящей группой является фенокси CH
5O −, который может быть сконденсирован перед камерой осаждения. [30]
Парилены могут придавать покрытию несколько желаемых качеств. Среди других свойств они
Поскольку процесс нанесения покрытия происходит при температуре окружающей среды в мягком вакууме, его можно применять даже к чувствительным к температуре объектам, таким как сухие биологические образцы. Низкая температура также приводит к низкому внутреннему напряжению в тонкой пленке. Более того, единственным газом в камере осаждения является мономер, без каких-либо растворителей, катализаторов или побочных продуктов, которые могли бы воздействовать на объект.
Парилен AF-4 и VT-4 оба фторированы и, как следствие, очень дороги по сравнению с париленами N и C, что серьезно ограничивает их коммерческое использование, за исключением узкоспециализированных приложений.
Парилен C и в меньшей степени AF-4, SF, HT (все один и тот же полимер) используются для покрытия печатных плат (ПП) и медицинских приборов . Существует множество других применений, поскольку парилен является отличным барьером для влаги. Это наиболее биоприемлемое покрытие для стентов, дефибрилляторов, кардиостимуляторов и других устройств, постоянно имплантируемых в тело. [33]
Классические молекулярные слои химии представляют собой самоорганизующиеся монослои (SAM). SAM представляют собой длинноцепочечные алкильные цепи, которые взаимодействуют с поверхностями на основе взаимодействия серы и металла (алкилтиолаты) [34] или реакции типа золь-гель с гидроксилированной оксидной поверхностью (трихлорсилилалкилы или триалкоксиалкилы). [35] Однако, если поверхность золота или оксида не обработана тщательно, а алкильная цепь длинная, эти SAM образуют неупорядоченные монослои, которые плохо упаковываются. [36] [37] Такое отсутствие упаковки вызывает проблемы, например, прилипание в устройствах MEMS . [38]
Наблюдение, что парилены могут образовывать упорядоченные молекулярные слои (ML), пришло с измерениями угла контакта , где ML толще 10 Å имели равновесный угол контакта 80 градусов (такой же, как у объемного парилена N), но более тонкие имели уменьшенный угол контакта. [32] Это также было подтверждено электрическими измерениями (измерениями напряжения смещения-температуры) с использованием конденсаторов металл-изолятор-полупроводник (MISCAP). [39] Короче говоря, парилен N и AF-4 (те парилены без функциональных групп) не имеют отверстий на уровне ~14 Å. Это происходит потому, что повторяющиеся единицы парилена обладают фенильным кольцом, и из-за высокой электронной поляризуемости фенильного кольца соседние повторяющиеся единицы упорядочиваются в плоскости XY. В результате этого взаимодействия ML парилена являются поверхностно-независимыми, за исключением переходных металлов, которые дезактивируют триплетное (бензоидное) состояние, и поэтому парилены не могут быть инициированы. Это открытие париленов как молекулярных слоев очень важно для промышленного применения из-за надежности процесса и того, что ML осаждаются при комнатной температуре. Таким образом, парилены могут использоваться в качестве диффузионных барьеров и для снижения поляризуемости поверхности (дезактивации оксидных поверхностей). Объединяя свойства реактивных париленов с наблюдением, что они могут образовывать плотные молекулярные слои без точечных отверстий, парилен X был использован в качестве интерфейса для секвенирования генома.
Одно предостережение относительно париленов молекулярного слоя, а именно, они осаждаются в виде олигомеров, а не высокополимерных. [32] В результате для преобразования олигомеров в высокополимерные требуется вакуумный отжиг. Для парилена N эта температура составляет 250 °C, тогда как для пайрлена AF-4 она составляет 300 °C.
Париленовые пленки нашли применение в различных областях, в том числе [1]
{{cite journal}}: Отсутствует или пусто |title=( помощь )