
Пентозофосфатный путь (также называемый фосфоглюконатным путем , гексозомонофосфатным шунтом и HMP-шунтом ) представляет собой метаболический путь, параллельный гликолизу . [1] Он генерирует НАДФН и пентозы (5- углеродные сахара ), а также рибозо-5-фосфат , предшественник синтеза нуклеотидов . [1] Хотя пентозофосфатный путь действительно включает окисление глюкозы , его основная роль – анаболическая , а не катаболическая . Этот путь особенно важен в красных кровяных тельцах (эритроцитах). Реакции этого пути были выяснены в начале 1950-х годов Бернардом Хорекером и его сотрудниками. [2] [3]
На этом пути выделяются две отдельные фазы. Первая — это окислительная фаза, в ходе которой образуется НАДФН, а вторая — неокислительный синтез 5-углеродных сахаров. Для большинства организмов пентозофосфатный путь протекает в цитозоле ; у растений большинство этапов происходит в пластидах . [4]
Как и гликолиз , пентозофосфатный путь, по-видимому, имеет очень древнее эволюционное происхождение. Реакции этого пути в современных клетках в основном катализируются ферментами, однако они протекают и неферментативно в условиях, повторяющих условия Архейского океана , и катализируются ионами металлов , особенно ионов железа (Fe(II)). [5] Это говорит о том, что истоки этого пути могут восходить к пребиотическому миру.
Основными результатами пути являются:
Ароматические аминокислоты, в свою очередь, являются предшественниками многих путей биосинтеза, включая лигнин в древесине. [ нужна цитата ]
Пищевые пентозные сахара, полученные в результате переваривания нуклеиновых кислот, могут метаболизироваться по пентозофосфатному пути, а углеродные скелеты пищевых углеводов могут превращаться в гликолитические/глюконеогенные промежуточные продукты.
У млекопитающих ППС встречается исключительно в цитоплазме. У человека он наиболее активен в печени, молочных железах и коре надпочечников. [ нужна цитация ] PPP является одним из трех основных способов, с помощью которых организм создает молекулы с восстанавливающей способностью, на его долю приходится примерно 60% производства НАДФН у людей. [ нужна цитата ]
Одним из применений НАДФН в клетке является предотвращение окислительного стресса . Он восстанавливает глутатион посредством глутатионредуктазы , которая превращает реактивную H 2 O 2 в H 2 O под действием глутатионпероксидазы . Если он отсутствует, H 2 O 2 будет преобразован в свободные гидроксильные радикалы с помощью химии Фентона , которые могут атаковать клетку. Эритроциты, например, генерируют большое количество НАДФН посредством пентозофосфатного пути, который используется для восстановления глутатиона.
Перекись водорода также вырабатывается фагоцитами в процессе, часто называемом респираторным взрывом . [6]
В этой фазе две молекулы НАДФ + восстанавливаются до НАДФН , используя энергию превращения глюкозо-6-фосфата в рибулозо-5-фосфат .

Всю совокупность реакций можно резюмировать следующим образом:
Общая реакция на этот процесс такова:
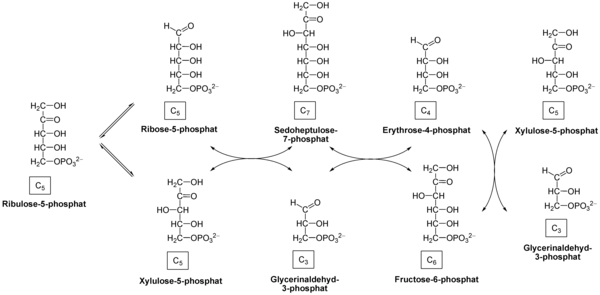
Чистая реакция: 3 рибулозо-5-фосфат → 1 рибозо-5-фосфат + 2 ксилулозо-5-фосфат → 2 фруктозо-6-фосфат + глицеральдегид-3-фосфат.
Глюкозо -6-фосфатдегидрогеназа является ферментом , контролирующим скорость этого пути . Аллостерически стимулируется НАДФ + и сильно ингибируется НАДФН . [7] Соотношение НАДФН:НАДФ + является основным способом регуляции фермента и обычно составляет около 100:1 в цитозоле печени . Это делает цитозоль высоковосстанавливающей средой. Путь использования НАДФН образует НАДФ + , который стимулирует глюкозо-6-фосфатдегидрогеназу для производства большего количества НАДФН. Этот этап также ингибируется ацетил-КоА . [ нужна цитата ]
Активность G6PD также посттрансляционно регулируется цитоплазматической деацетилазой SIRT2 . SIRT2-опосредованное деацетилирование и активация G6PD стимулирует окислительную ветвь PPP для снабжения цитозольного НАДФН для противодействия окислительному повреждению или поддержки липогенеза de novo . [8] [9]
Было обнаружено, что некоторые недостатки уровня активности (а не функции) глюкозо-6-фосфатдегидрогеназы связаны с устойчивостью к малярийному паразиту Plasmodium falciparum среди лиц средиземноморского и африканского происхождения. Основанием для этой устойчивости может быть ослабление мембраны эритроцитов (эритроцит является клеткой-хозяином паразита), так что они не могут поддерживать жизненный цикл паразита достаточно долго для продуктивного роста. [10]