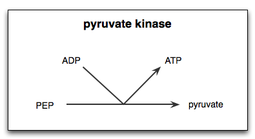
Пируваткиназа — это фермент , участвующий в последнем этапе гликолиза . Он катализирует перенос фосфатной группы из фосфоенолпирувата (ФЕП) в аденозиндифосфат (АДФ), в результате чего образуется одна молекула пирувата и одна молекула АТФ . [1] Пируваткиназа была названа неправильно (несоответствуя обычной киназе ) до того, как было признано, что она не катализирует напрямую фосфорилирование пирувата , которое не происходит в физиологических условиях. [2] Пируваткиназа присутствует в четырех различных тканеспецифичных изоферментах у животных, каждый из которых состоит из определенных кинетических свойств, необходимых для приспособления к изменениям метаболических потребностей различных тканей.
Четыре изофермента пируваткиназы, экспрессируемые у позвоночных: L (печень), R (эритроциты), M1 (мышцы и мозг) и M2 (ранняя фетальная ткань и большинство тканей взрослого человека). Изоферменты L и R экспрессируются геном PKLR , тогда как изоферменты M1 и M2 экспрессируются геном PKM2 . Изоферменты R и L отличаются от M1 и M2 тем, что они аллостерически регулируются. Кинетически изоферменты R и L пируваткиназы имеют два различных конформационных состояния: одно с высоким сродством к субстрату и одно с низким сродством к субстрату. R-состояние, характеризующееся высоким сродством к субстрату, служит активированной формой пируваткиназы и стабилизируется PEP и фруктозо-1,6-бисфосфатом (FBP), способствуя гликолитическому пути. Состояние T, характеризующееся низким сродством к субстрату, служит инактивированной формой пируваткиназы, связанной и стабилизированной АТФ и аланином , вызывая фосфорилирование пируваткиназы и ингибирование гликолиза. [3] Изофермент M2 пируваткиназы может образовывать тетрамеры или димеры. Тетрамеры имеют высокое сродство к PEP, тогда как димеры имеют низкое сродство к PEP. Ферментативная активность может регулироваться фосфорилированием высокоактивных тетрамеров PKM2 в неактивные димеры. [4]
Ген PKM состоит из 12 экзонов и 11 интронов . PKM1 и PKM2 являются различными продуктами сплайсинга гена M (PKM1 содержит экзон 9, тогда как PKM2 содержит экзон 10) и отличаются только 23 аминокислотами в пределах 56-аминокислотного участка (аминокислотные остатки 378-434) на их карбокси-конце . [5] [6] Ген PKM регулируется посредством гетерогенных рибонуклеотидных белков, таких как hnRNPA1 и hnRNPA2. [7] Мономер человеческого PKM2 состоит из 531 аминокислоты и представляет собой одну цепь, разделенную на домены A, B и C. Разница в аминокислотной последовательности между PKM1 и PKM2 позволяет PKM2 аллостерически регулироваться FBP и образовывать димеры и тетрамеры, тогда как PKM1 может образовывать только тетрамеры. [8]
Многие энтеробактерии, включая E. coli , имеют две изоформы пируваткиназы, PykA и PykF, которые на 37% идентичны в E. coli (Uniprot: PykA, PykF). Они катализируют ту же реакцию, что и у эукариот, а именно, генерацию АТФ из АДФ и ФЭП, последний шаг в гликолизе , шаг, который необратим в физиологических условиях. PykF аллостерически регулируется FBP, что отражает центральное положение PykF в клеточном метаболизме. [9] Транскрипция PykF в E. coli регулируется глобальным транскрипционным регулятором Cra (FruR). [10] [11] [12] Было показано, что PfkB ингибируется MgATP при низких концентрациях Fru-6P, и эта регуляция важна для глюконеогенеза . [13]
В реакции пируваткиназы в гликолизе есть два этапа. Во-первых, PEP переносит фосфатную группу в АДФ, производя АТФ и енолят пирувата. Во-вторых, к еноляту пирувата должен быть добавлен протон, чтобы получить функциональную форму пирувата, которая требуется клетке. [14] Поскольку субстратом для пируваткиназы является простой фосфосахар, а продуктом является АТФ, пируваткиназа является возможным основным ферментом для эволюции цикла гликолиза и может быть одним из самых древних ферментов во всей земной жизни. Фосфоенолпируват мог присутствовать абиотически и, как было показано, вырабатывается с высоким выходом в примитивном пути триозогликолиза. [15]
В клетках дрожжей взаимодействие дрожжевой пируваткиназы (YPK) с PEP и ее аллостерическим эффектором фруктозо-1,6-бисфосфатом (FBP) усиливается присутствием Mg 2+ . Поэтому был сделан вывод, что Mg 2+ является важным кофактором в катализе PEP в пируват пируваткиназой. Кроме того, было показано, что ион металла Mn 2+ оказывает схожее, но более сильное воздействие на YPK, чем Mg 2+ . Связывание ионов металла с участками связывания металла на пируваткиназе увеличивает скорость этой реакции. [16]
Реакция, катализируемая пируваткиназой, является заключительным этапом гликолиза. Это один из трех этапов, ограничивающих скорость этого пути. Этапы, ограничивающие скорость, являются более медленными, регулируемыми этапами пути и, таким образом, определяют общую скорость пути. В гликолизе этапы, ограничивающие скорость, связаны либо с гидролизом АТФ, либо с фосфорилированием АДФ, в результате чего путь становится энергетически выгодным и по существу необратимым в клетках. Этот заключительный этап строго регулируется и намеренно необратим, поскольку пируват является важнейшим промежуточным строительным блоком для дальнейших метаболических путей. [17] После того, как пируват произведен, он либо входит в цикл трикарбоновых кислот для дальнейшего производства АТФ в аэробных условиях, либо преобразуется в молочную кислоту или этанол в анаэробных условиях.
Пируваткиназа также служит регуляторным ферментом для глюконеогенеза , биохимического пути, в котором печень генерирует глюкозу из пирувата и других субстратов. Глюконеогенез использует неуглеводные источники для обеспечения мозга и эритроцитов глюкозой во время голодания, когда прямые запасы глюкозы истощены. [17] Во время голодания пируваткиназа ингибируется, тем самым предотвращая «утечку» фосфоенолпирувата из превращения в пируват; [17] вместо этого фосфоенолпируват превращается в глюкозу через каскад реакций глюконеогенеза . Хотя он использует похожие ферменты, глюконеогенез не является обратным гликолизу. Вместо этого это путь, который обходит необратимые этапы гликолиза. Более того, глюконеогенез и гликолиз не происходят одновременно в клетке в любой данный момент, поскольку они взаимно регулируются клеточной сигнализацией. [17] После завершения пути глюконеогенеза выработанная глюкоза выводится из печени, обеспечивая энергией жизненно важные ткани в состоянии голодания.
Гликолиз строго регулируется на трех его каталитических этапах: фосфорилирование глюкозы гексокиназой , фосфорилирование фруктозо-6-фосфата фосфофруктокиназой и перенос фосфата от PEP к ADP пируваткиназой. В условиях дикого типа все три эти реакции необратимы, имеют большую отрицательную свободную энергию и отвечают за регуляцию этого пути. [17] Активность пируваткиназы наиболее широко регулируется аллостерическими эффекторами, ковалентными модификаторами и гормональным контролем. Однако наиболее значимым регулятором пируваткиназы является фруктозо-1,6-бисфосфат (FBP), который служит аллостерическим эффектором для фермента.
Аллостерическая регуляция — это связывание эффектора с сайтом на белке, отличным от активного сайта, вызывающее конформационные изменения и изменяющее активность данного белка или фермента. Было обнаружено, что пируваткиназа аллостерически активируется FBP и аллостерически инактивируется АТФ и аланином. [18] Тетрамеризация пируваткиназы стимулируется FBP и серином, тогда как диссоциация тетрамера стимулируется L-цистеином. [19] [20] [21]
FBP является наиболее значимым источником регуляции, поскольку он исходит из пути гликолиза. FBP является гликолитическим промежуточным продуктом, полученным в результате фосфорилирования фруктозо-6-фосфата . FBP связывается с аллостерическим сайтом связывания на домене C пируваткиназы и изменяет конформацию фермента, вызывая активацию активности пируваткиназы. [22] Как промежуточный продукт, присутствующий в гликолитическом пути, FBP обеспечивает прямую стимуляцию, поскольку чем выше концентрация FBP, тем больше аллостерическая активация и величина активности пируваткиназы. Пируваткиназа наиболее чувствительна к эффектам FBP. В результате, остальные регуляторные механизмы служат вторичной модификацией. [9] [23]
Ковалентные модификаторы служат косвенными регуляторами, контролируя фосфорилирование, дефосфорилирование, ацетилирование, сукцинилирование и окисление ферментов, что приводит к активации и ингибированию ферментативной активности. [24] В печени глюкагон и адреналин активируют протеинкиназу А , которая служит ковалентным модификатором, фосфорилируя и дезактивируя пируваткиназу. Напротив, секреция инсулина в ответ на повышение уровня сахара в крови активирует фосфопротеинфосфатазу I, вызывая дефосфорилирование и активацию пируваткиназы для увеличения гликолиза. Та же ковалентная модификация оказывает противоположное действие на ферменты глюконеогенеза. Эта система регуляции отвечает за предотвращение бесполезного цикла посредством предотвращения одновременной активации пируваткиназы и ферментов, катализирующих глюконеогенез. [25]
Для предотвращения бесполезного цикла гликолиз и глюконеогенез жестко регулируются, чтобы гарантировать, что они никогда не будут работать в клетке одновременно. В результате ингибирование пируваткиназы глюкагоном, циклическим АМФ и адреналином не только останавливает гликолиз, но и стимулирует глюконеогенез. С другой стороны, инсулин вмешивается в действие глюкагона, циклического АМФ и адреналина, заставляя пируваткиназу нормально функционировать и останавливать глюконеогенез. Кроме того, было обнаружено, что глюкоза ингибирует и нарушает глюконеогенез, оставляя активность пируваткиназы и гликолиз незатронутыми. В целом, взаимодействие между гормонами играет ключевую роль в функционировании и регуляции гликолиза и глюконеогенеза в клетке. [26]
Метформин, или диметилбигуанид , является основным средством лечения диабета 2 типа. Было показано, что метформин косвенно влияет на пируваткиназу через ингибирование глюконеогенеза. В частности, добавление метформина связано с заметным снижением потока глюкозы и увеличением потока лактата/пирувата из различных метаболических путей. Хотя метформин напрямую не влияет на активность пируваткиназы, он вызывает снижение концентрации АТФ. Из-за аллостерического ингибирующего воздействия АТФ на пируваткиназу, снижение АТФ приводит к уменьшению ингибирования и последующей стимуляции пируваткиназы. Следовательно, увеличение активности пируваткиназы направляет метаболический поток через гликолиз, а не глюконеогенез. [27]
Гетерогенные рибонуклеотидные белки (hnRNP) могут воздействовать на ген PKM, регулируя экспрессию изоформ M1 и M2. Изоформы PKM1 и PKM2 являются вариантами сплайсинга гена PKM, которые отличаются одним экзоном. Различные типы hnRNP, такие как hnRNPA1 и hnRNPA2, проникают в ядро в условиях гипоксии и модулируют экспрессию таким образом, что PKM2 повышается. [28] Гормоны, такие как инсулин, повышают экспрессию PKM2, в то время как гормоны, такие как трийодтиронин (T3) и глюкагон, способствуют снижению регуляции PKM2. [29]
ChREBP — это фактор транскрипции , который регулирует экспрессию L-изофермента пируваткиназы. [30] Модуль, чувствительный к глюкозе, содержит домены, которые являются мишенями для регуляторного фосфорилирования на основе концентраций глюкозы и цАМФ, которые затем контролируют его импорт в ядро. [31] Он также может быть дополнительно активирован путем прямого связывания глюкозо-6-фосфата. [30] [32] Попав в ядро, его домены связывания ДНК активируют транскрипцию пируваткиназы. [31] Таким образом, высокий уровень глюкозы и низкий уровень цАМФ вызывают дефосфорилирование ChREBP , что затем повышает экспрессию пируваткиназы в печени. [30]
Генетические дефекты этого фермента вызывают заболевание, известное как дефицит пируваткиназы . При этом состоянии недостаток пируваткиназы замедляет процесс гликолиза. Этот эффект особенно разрушительный в клетках, в которых отсутствуют митохондрии , поскольку эти клетки должны использовать анаэробный гликолиз в качестве единственного источника энергии, поскольку цикл трикарбоновых кислот недоступен. Например, эритроциты , которые в состоянии дефицита пируваткиназы, быстро становятся дефицитными по АТФ и могут подвергаться гемолизу . Следовательно, дефицит пируваткиназы может вызвать хроническую несфероцитарную гемолитическую анемию (CNSHA). [33]
Дефицит пируваткиназы вызывается аутосомно-рецессивным признаком. У млекопитающих есть два гена пируваткиназы, PK-LR (который кодирует изоферменты пируваткиназы L и R) и PK-M (который кодирует изофермент пируваткиназы M1), но только PKLR кодирует изофермент красной крови, который влияет на дефицит пируваткиназы. Было идентифицировано более 250 мутаций гена PK-LR, связанных с дефицитом пируваткиназы. Тестирование ДНК привело к обнаружению местоположения PKLR на хромосоме 1 и разработке прямых тестов секвенирования генов для молекулярной диагностики дефицита пируваткиназы. [34]
Активные формы кислорода (ROS) являются химически активными формами кислорода. Было показано, что в клетках легких человека ROS ингибируют изофермент M2 пируваткиназы (PKM2). ROS достигает этого ингибирования путем окисления Cys358 и инактивации PKM2. В результате инактивации PKM2 поток глюкозы больше не преобразуется в пируват, а вместо этого используется в пентозофосфатном пути, что приводит к снижению и детоксикации ROS. Таким образом, вредное воздействие ROS усиливается и вызывает больший окислительный стресс в клетках легких, что приводит к потенциальному образованию опухолей. Этот ингибиторный механизм важен, поскольку он может предполагать, что регуляторные механизмы в PKM2 отвечают за помощь раковым клеткам в устойчивости к окислительному стрессу и усилении опухолеобразования. [35] [36]
Установлено, что фенилаланин действует как конкурентный ингибитор пируваткиназы в мозге. Хотя степень ингибирующей активности фенилаланина одинакова как в фетальных, так и в взрослых клетках, ферменты в фетальных клетках мозга значительно более уязвимы для ингибирования, чем ферменты во взрослых клетках мозга. Исследование PKM2 у младенцев с генетическим заболеванием мозга фенилкетонурией (PKU) показало повышенные уровни фенилаланина и сниженную эффективность PKM2. Этот ингибирующий механизм дает представление о роли пируваткиназы в повреждении клеток мозга. [37] [38]
Раковые клетки характеризуются ускоренным метаболическим механизмом, и считается, что пируваткиназа играет роль в развитии рака. По сравнению со здоровыми клетками, раковые клетки имеют повышенные уровни изоформы PKM2, в частности, димера с низкой активностью. Поэтому сывороточные уровни PKM2 используются в качестве маркеров рака. Димер с низкой активностью позволяет накапливать фосфоенолпируват (PEP), оставляя большие концентрации гликолитических промежуточных продуктов для синтеза биомолекул, которые в конечном итоге будут использоваться раковыми клетками. [8] Фосфорилирование PKM2 митоген-активируемой протеинкиназой 1 (ERK2) вызывает конформационные изменения, которые позволяют PKM2 проникать в ядро и регулировать экспрессию гликолитического гена, необходимую для развития опухоли. [39] Некоторые исследования утверждают, что во время канцерогенеза происходит сдвиг в экспрессии с PKM1 на PKM2. Микроокружение опухоли, такое как гипоксия, активирует факторы транскрипции, такие как фактор, индуцируемый гипоксией, для стимуляции транскрипции PKM2, который образует положительную обратную связь для усиления собственной транскрипции. [8]
Обратимый фермент с похожей функцией, пируватфосфатдикиназа (PPDK), обнаружен в некоторых бактериях и был передан ряду анаэробных эукариотических групп (например, Streblomastix , Giardia , Entamoeba и Trichomonas ), по-видимому, посредством горизонтального переноса генов в двух или более случаях. В некоторых случаях один и тот же организм будет иметь как пируваткиназу, так и PPDK. [40]