ДНК-праймаза — это фермент, участвующий в репликации ДНК , и тип РНК-полимеразы . Праймаза катализирует синтез короткого сегмента РНК (или ДНК в некоторых живых организмах [1] ), называемого праймером , комплементарным шаблону одноцепочечной ДНК ( ssDNA ). После этого удлинения часть РНК удаляется экзонуклеазой 5'-3' и заполняется ДНК.

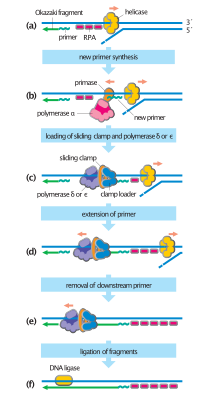
В бактериях праймаза связывается с ДНК-хеликазой, образуя комплекс, называемый примосомой . Праймаза активируется геликазой, где она затем синтезирует короткий РНК-праймер длиной приблизительно 11 ±1 нуклеотидов , к которому новые нуклеотиды могут быть добавлены ДНК-полимеразой. Архейные и эукариотические праймазы являются гетеродимерными белками с одной большой регуляторной и одной маленькой каталитической субъединицей. [2]
Сегменты РНК сначала синтезируются праймазой, а затем удлиняются ДНК-полимеразой. [3] Затем ДНК-полимераза образует белковый комплекс с двумя субъединицами праймазы, образуя комплекс альфа-ДНК-полимераза-праймаза. Праймаза является одной из самых подверженных ошибкам и медленных полимераз. [3] Праймазы в таких организмах, как E. coli, синтезируют около 2000-3000 праймеров со скоростью один праймер в секунду. [4] Праймаза также действует как механизм остановки, предотвращая опережение лидирующей цепи отстающей , останавливая продвижение репликационной вилки . [5] Скорость определяющим этапом в праймазе является образование первой фосфодиэфирной связи между двумя молекулами РНК. [3]
Механизмы репликации различаются у разных бактерий и вирусов , где праймаза ковалентно связана с хеликазой в вирусах, таких как бактериофаг T7 . [5] В вирусах, таких как вирус простого герпеса (HSV-1), праймаза может образовывать комплексы с хеликазой. [6] Комплекс праймаза-хеликаза используется для раскручивания двухцепочечной ДНК (двуцепочечной) и синтезирует отстающую цепь с использованием праймеров РНК . [6] Большинство праймеров, синтезируемых праймазой, имеют длину от двух до трех нуклеотидов. [6]
Существует два основных типа праймазы: DnaG, обнаруженная в большинстве бактерий, и суперсемейство AEP (Archaeo-Eukaryote Primase), обнаруженное в архейных и эукариотических праймазах. В то время как бактериальные праймазы ( тип DnaG ) состоят из одной белковой единицы (мономера) и синтезируют РНК-праймеры, праймазы AEP обычно состоят из двух различных праймазных единиц (гетеродимера) и синтезируют двухкомпонентные праймеры с компонентами как РНК, так и ДНК. [7] Несмотря на функциональное сходство, два суперсемейства праймазов развивались независимо друг от друга.
Кристаллическая структура праймазы в E. coli с ядром, содержащим белок DnaG , была определена в 2000 году. [4] Комплекс DnaG и праймазы имеет форму кешью и содержит три субдомена. [4] Центральный субдомен образует складку топрима, которая состоит из смеси пяти бета-слоев и шести альфа-спиралей . [4] [8] Складка топрима используется для связывания регуляторов и металлов. Праймаза использует домен фосфотрансфера для координации переноса металлов, что отличает ее от других полимераз. [4] Боковые субъединицы содержат NH 2 и COOH-конец , состоящий из альфа-спиралей и бета-слоев. [4] NH 2- конец взаимодействует с доменом связывания цинка и COOH-концевой областью, которая взаимодействует с DnaB-ID. [4]
Складка Toprim также обнаружена в топоизомеразе и митохондриальной праймазе/хеликазе Twinkle . [8] Некоторые праймазы, подобные DnaG (бактериальным; InterPro : IPR020607 ), были обнаружены в геномах архей. [9]
Эукариотические и архейные примазы, как правило, более похожи друг на друга с точки зрения структуры и механизма, чем на бактериальные примазы. [10] [11] Суперсемейство архейно-эукариотических примаз (AEP), к которому принадлежит большинство каталитических субъединиц эукариотических и архейных примаз, недавно было переопределено как семейство примаз-полимераз в знак признания многих других ролей, которые играют ферменты в этом семействе. [12] Эта классификация также подчеркивает широкое происхождение AEP-примаз; в настоящее время суперсемейство признано переходным между функциями РНК и ДНК. [13]
Праймазы архей и эукариот представляют собой гетеродимерные белки с одной большой регуляторной (человеческий PRIM2 , p58) и одной маленькой каталитической субъединицей (человеческий PRIM1 , p48/p49). [2] Большая субъединица содержит N-концевой кластер 4Fe–4S, разделенный в некоторых археях как PriX/PriCT. [14] Большая субъединица участвует в улучшении активности и специфичности малой субъединицы. Например, удаление части, соответствующей большой субъединице в слитом белке PolpTN2, приводит к более медленному ферменту с активностью обратной транскриптазы. [13]

Семейство праймазов-полимераз AEP имеет разнообразные особенности, выходящие за рамки создания только праймеров. Помимо праймирования ДНК во время репликации, ферменты AEP могут иметь дополнительные функции в процессе репликации ДНК, такие как полимеризация ДНК или РНК, терминальный перенос , синтез транслезиона (TLS) , негомологичное соединение концов (NHEJ) [ 12] и, возможно, перезапуск остановленных репликационных вилок. [15] Праймазы обычно синтезируют праймеры из рибонуклеотидов (NTP); однако праймазы с полимеразными возможностями также имеют сродство к дезоксирибонуклеотидам (dNTP). [16] [11] Праймазы с терминальной трансферазной функциональностью способны добавлять нуклеотиды к 3'-концу цепи ДНК независимо от матрицы. Другие ферменты, участвующие в репликации ДНК, такие как геликазы, также могут проявлять праймазную активность. [17]
Человеческий PrimPol (ccdc111 [16] ) выполняет функции как праймазы, так и полимеразы, как и многие архейные праймазы; проявляет терминальную трансферазную активность в присутствии марганца; и играет важную роль в синтезе транслезиона [18] и в перезапуске остановленных репликационных вилок. PrimPol активно привлекается к поврежденным участкам посредством взаимодействия с RPA, адаптерным белком, который облегчает репликацию и восстановление ДНК. [15] PrimPol имеет домен цинкового пальца, похожий на домен некоторых вирусных праймазов, который необходим для синтеза транслезиона и активности праймазы и может регулировать длину праймера. [18] В отличие от большинства праймазов, PrimPol уникально способен начинать цепи ДНК с dNTP. [16]
PriS, малая субъединица архейной праймазы, играет роль в синтезе транслезиона (TLS) и может обходить обычные повреждения ДНК. У большинства архей отсутствуют специализированные полимеразы, которые выполняют TLS у эукариот и бактерий. [19] PriS в одиночку преимущественно синтезирует цепочки ДНК; но в сочетании с PriL, большой субъединицей, активность РНК-полимеразы увеличивается. [20]
В Sulfolobus solfataricus гетеродимер праймазы PriSL может действовать как праймаза, полимераза и терминальная трансфераза. Считается, что PriSL инициирует синтез праймера с помощью NTP, а затем переключается на dNTP. Фермент может полимеризовать цепи РНК или ДНК, при этом длина продуктов ДНК может достигать 7000 нуклеотидов (7 кб). Предполагается, что эта двойная функциональность может быть общей чертой архейных праймазов. [11]
AEP multifutional primases также появляются в бактериях и фагах, которые их инфицируют. Они могут демонстрировать новые доменные организации с доменами, которые приносят еще больше функций за пределы полимеризации. [14]
Бактериальный LigD ( A0R3R7 ) в первую очередь участвует в пути NHEJ. Он имеет домен полимеразы/праймазы суперсемейства AEP, домен 3'-фосфоэстеразы и домен лигазы. Он также способен к активности праймазы, ДНК и РНК полимеразы и терминальной трансферазы. Активность полимеризации ДНК может производить цепи длиной более 7000 нуклеотидов (7 кб), в то время как полимеризация РНК производит цепи длиной до 1 кб. [21]
Ферменты AEP широко распространены и могут быть обнаружены закодированными в мобильных генетических элементах, включая вирусы/фаги и плазмиды. Они используют их либо как единственный репликационный белок, либо в сочетании с другими белками, связанными с репликацией, такими как геликазы и, реже, ДНК-полимеразы. [22] В то время как присутствие AEP в эукариотических и архейных вирусах ожидается, поскольку они отражают своих хозяев, [22] бактериальные вирусы и плазмиды также часто кодируют ферменты суперсемейства AEP, как и праймазы семейства DnaG. [14] Большое разнообразие семейств AEP было обнаружено в различных бактериальных плазмидах с помощью сравнительных геномных исследований. [14] Их эволюционная история в настоящее время неизвестна, поскольку они, обнаруженные в бактериях и бактериофагах, кажутся слишком отличными от своих архео-эукариотических гомологов для недавнего горизонтального переноса генов . [22]
MCM-подобная геликаза в штамме Bacillus cereus ATCC 14579 (BcMCM; Q81EV1 ) представляет собой геликазу SF6, слитую с AEP-праймазой. Фермент обладает как праймазной, так и полимеразной функциями в дополнение к функции геликазы. Ген, кодирующий его, находится в профаге. [17] Он гомологичен ORF904 плазмиды pRN1 из Sulfolobus islandicus , которая имеет домен AEP PrimPol. [23] Вирус коровьей оспы D5 и HSV Primase также являются примерами слияния AEP-хеликазы. [12] [6]
PolpTN2 — это архейная праймаза, обнаруженная в плазмиде TN2. Слияние доменов, гомологичных PriS и PriL, проявляет как праймазную, так и ДНК-полимеразную активность, а также функцию терминальной трансферазы. В отличие от большинства праймаз, PolpTN2 образует праймеры, состоящие исключительно из dNTP. [13] Неожиданно, когда PriL-подобный домен был усечен, PolpTN2 также смог синтезировать ДНК на матрице РНК, т. е. действовал как РНК-зависимая ДНК-полимераза (обратная транскриптаза). [13]
Даже праймазы DnaG могут иметь дополнительные функции, если им дать правильные домены. Фаг T7 gp4 представляет собой слияние праймазы DnaG-хеликазы и выполняет обе функции при репликации. [5]