Реакция Гаттермана (также известная как формилирование Гаттермана и синтез салицилальдегида Гаттермана ) — это химическая реакция, в которой ароматические соединения формилируются смесью цианида водорода (HCN) и хлористого водорода (HCl) в присутствии катализатора на основе кислоты Льюиса, такого как хлорид алюминия (AlCl 3 ). [1] Она названа в честь немецкого химика Людвига Гаттермана [2] и похожа на реакцию Фриделя–Крафтса .
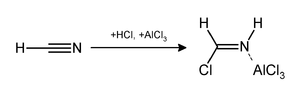

Модификации показали, что вместо цианистого водорода можно использовать цианистый натрий или бромистый циан . [3]
Реакцию можно упростить, заменив комбинацию HCN/AlCl 3 на цианид цинка . [4] Хотя Zn(CN) 2 также очень токсичен, он является твердым веществом, что делает работу с ним более безопасной, чем с газообразным HCN. [5] Zn(CN) 2 реагирует с HCl, образуя ключевой реагент HCN и Zn(Cl) 2 , который служит катализатором кислоты Льюиса in situ . Примером метода Zn(CN) 2 является синтез мезитальдегида из мезитилена . [6]
Реакция Гаттермана -Коха , названная в честь немецких химиков Людвига Гаттермана и Юлиуса Арнольда Коха , [7] является вариантом реакции Гаттермана, в которой вместо цианистого водорода используется оксид углерода (CO). [8]

В отличие от реакции Гаттермана, эта реакция неприменима к субстратам фенола и фенолового эфира . [5] Хотя изначально крайне нестабильный формилхлорид постулировался как промежуточное вещество, катион формила (т. е. протонированный монооксид углерода), [HCO] + , теперь считается, что он напрямую реагирует с ареном без первоначального образования формилхлорида. [9] Кроме того, когда в качестве кислоты Льюиса вместо хлорида алюминия используется хлорид цинка, например, или когда монооксид углерода не используется при высоком давлении, часто необходимо присутствие следов хлорида меди (I) или хлорида никеля (II) в качестве сокатализатора. Сокатализатор на основе переходного металла может служить «носителем», сначала реагируя с CO с образованием карбонильного комплекса, который затем преобразуется в активный электрофил. [10]